
【题目】向有机聚合物中添加阻燃剂,可增大聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,其生产工艺如图1所示:

请完成下列填空:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],发生反应的化学方程式为___。
(2)合成反应后,继续在393~523K下水热处理8h,发生反应Mg(OH)2-xClxmH2O=(1-![]() )Mg(OH)2+
)Mg(OH)2+![]() MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
(3)阻燃型Mg(OH)2具有晶粒大、易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是___和___。
(4)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g) △H=+81.5kJmol-1
Al(OH)3(s)![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g) △H=+87.7kJmol-1
H2O(g) △H=+87.7kJmol-1
Mg(OH)2和A1(OH)3起阻燃作用的主要原因是:___
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程图2(框内写产物的化学式,箭头上下标明转化条件或操作名称):___、___、___、___。

【答案】2MgCl2+(2-x)Ca(OH)2+2mH2O=2[Mg(OH)2-xClxmH2O]+(2-x)CaCl2 除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2、Ca(OH)2等 水热处理 表面处理 Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降,同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳 氢氧化镁 MgCl2 蒸发浓缩、冷却结晶 HCl
【解析】
![]() 石灰乳是氢氧化钙,
石灰乳是氢氧化钙,![]() 与适量石灰乳反应合成碱式氯化镁
与适量石灰乳反应合成碱式氯化镁![]() ,依据元素守恒,可得反应方程式。
,依据元素守恒,可得反应方程式。
![]() 此反应除生成氢氧化镁外,还生成
此反应除生成氢氧化镁外,还生成![]() 、
、![]() ,另外还可能生成氢氧化钙,由此可推出水洗的目的。
,另外还可能生成氢氧化钙,由此可推出水洗的目的。
![]() 阻燃型
阻燃型![]() 具有晶粒大,易分散、与高分子材料相容性好等特点,分析工艺流程,找出相关操作。
具有晶粒大,易分散、与高分子材料相容性好等特点,分析工艺流程,找出相关操作。
![]() 和
和![]() 受热分解时吸收大量的热,从温度降低、产物耐高温方面进行分析。
受热分解时吸收大量的热,从温度降低、产物耐高温方面进行分析。
![]() 先加入熟石灰,熟石灰与精制卤水中的氯化镁反应生成氢氧化镁白色沉淀,过滤后再加入盐酸,氢氧化镁与盐酸反应生成氯化镁和水,通入HCl蒸发得到氯化镁,氯化镁在通电的条件下生成镁和氯气。由此分析,寻找答案。
先加入熟石灰,熟石灰与精制卤水中的氯化镁反应生成氢氧化镁白色沉淀,过滤后再加入盐酸,氢氧化镁与盐酸反应生成氯化镁和水,通入HCl蒸发得到氯化镁,氯化镁在通电的条件下生成镁和氯气。由此分析,寻找答案。
![]() 石灰乳是氢氧化钙,
石灰乳是氢氧化钙,![]() 与适量石灰乳反应合成碱式氯化镁
与适量石灰乳反应合成碱式氯化镁![]() ,依据元素守恒,化学反应方程式为:
,依据元素守恒,化学反应方程式为:![]() 。
。
答案为:![]() ;
;
![]() 此反应除生成氢氧化镁外,还生成
此反应除生成氢氧化镁外,还生成![]() 、
、![]() ,另外还可能生成氢氧化钙,故水洗的目的是:除去附着在
,另外还可能生成氢氧化钙,故水洗的目的是:除去附着在![]() 表面的可溶性物质
表面的可溶性物质![]() 、
、![]() 、
、![]() 等。
等。
答案为:除去附着在![]() 表面的可溶性物质
表面的可溶性物质![]() 、
、![]() 、
、![]() 等;
等;
![]() 阻燃型
阻燃型![]() 具有晶粒大,易分散、与高分子材料相容性好等特点,上述工艺流程中通过水热处理和表面处理可以使氢氧化镁晶体具有此特点。答案为:水热处理、表面处理;
具有晶粒大,易分散、与高分子材料相容性好等特点,上述工艺流程中通过水热处理和表面处理可以使氢氧化镁晶体具有此特点。答案为:水热处理、表面处理;
![]() 和
和![]() 受热分解时吸收大量的热,使环境温度下降,使环境稳定达到着火点以下,阻止了燃料的燃烧;且生成耐高温、稳定性好的MgO、
受热分解时吸收大量的热,使环境温度下降,使环境稳定达到着火点以下,阻止了燃料的燃烧;且生成耐高温、稳定性好的MgO、![]() 覆盖在可燃物表面,使阻燃效果更佳。答案为:
覆盖在可燃物表面,使阻燃效果更佳。答案为:![]() 和
和![]() 受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO、
受热分解时吸收大量的热,使环境温度下降;同时生成耐高温、稳定性好的MgO、![]() 覆盖在可燃物表面,阻燃效果更佳;
覆盖在可燃物表面,阻燃效果更佳;
![]() 先加入熟石灰,熟石灰与精制卤水中的氯化镁反应生成氢氧化镁白色沉淀,过滤后再加入盐酸,氢氧化镁与盐酸反应生成氯化镁和水,通入HCl蒸发得到氯化镁,氯化镁在通电的条件下生成镁和氯气,故此流程如下:
先加入熟石灰,熟石灰与精制卤水中的氯化镁反应生成氢氧化镁白色沉淀,过滤后再加入盐酸,氢氧化镁与盐酸反应生成氯化镁和水,通入HCl蒸发得到氯化镁,氯化镁在通电的条件下生成镁和氯气,故此流程如下:
答案为:氢氧化镁;![]() ;蒸发浓缩、冷却结晶;HCl。
;蒸发浓缩、冷却结晶;HCl。


科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
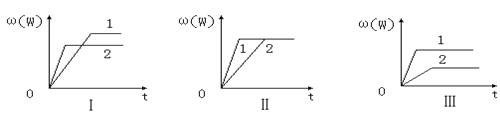
A.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟的“人工树叶”电化学装置如图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极。已知装置的电流效率等于生成产品所需的电子数与电路中通过的总电子数之比。下列说法不正确的是( )

A.该装置中Y电极发生氧化反应
B.X电极的电极反应式为6CO2+24e-+24H+=C6H12O6+6H2O
C.理论上,每生成22.4LCO2必有4molH+由Y极区向X极区迁移
D.当电路中通过3mol电子时生成18gC6H12O6,则该装置的电流效率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。请回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的△H=________
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=___
molL-1min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为___,该温度下平衡常数K=___。
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___反应(填“放热”或“吸热”)。
在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时,![]() =___。
=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烷燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是
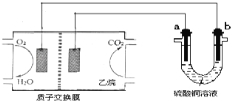
A.燃料电池工作时,正极反应为O2+2H2O+4e-═ 4OH-
B.a极是铜,b极是铁时,硫酸铜溶液浓度减小
C.a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的比为7/2
D.a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类不同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com