
【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。请回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的△H=________
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=___
molL-1min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为___,该温度下平衡常数K=___。
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___反应(填“放热”或“吸热”)。
在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时,![]() =___。
=___。
【答案】-122.7kJ/mol 5.1×10-5mol/(Lmin) 75% 7.5×10-5 放热 0.8
【解析】
![]()
![]()
![]()
![]()
![]()
![]()
由盖斯定律![]() 的H。
的H。
(2) ①设CH3OCH3的变化量为x ,则0~6.5min内反应的三段式为
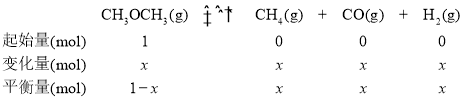
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,便可求出
,便可求出![]() min内的平均反应速率
min内的平均反应速率![]() 。
。
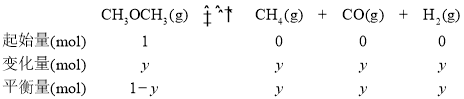
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,便可求出反应达平衡时,二甲醚的分解率;
,便可求出反应达平衡时,二甲醚的分解率;![]() ,
,![]() ,平衡常数
,平衡常数![]() ,代入数据,可求出K。
,代入数据,可求出K。
![]() 升高温度,
升高温度,![]() 的浓度增大,说明平衡逆向移动,由此可推出正反应类型。
的浓度增大,说明平衡逆向移动,由此可推出正反应类型。
当反应达到平衡时![]() ,则
,则![]() ;
;![]() K、
K、![]() 时,设起始时
时,设起始时![]() ,则
,则
反应的三段式为

所以![]() ,
,![]() ,所以
,所以![]() 、
、![]() ,
,![]() ,代入数据便可得出结果 。
,代入数据便可得出结果 。
![]()
![]()
![]()
![]()
![]()
![]()
由盖斯定律![]() 有
有![]() 的
的![]()
![]()
![]()
![]()
![]() ;
;
![]() 的
的![]()
![]() 。答案为:
。答案为:![]()
![]() ;
;
(2) ①设C3OCH3的变化量为x ,则0~6.5min内反应的三段式
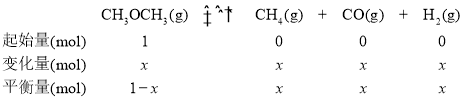
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,
,![]() min内的平均反应速率
min内的平均反应速率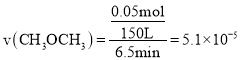
![]() ;
;
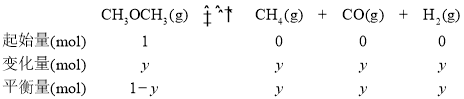
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,反应达平衡时,二甲醚的分解率
,反应达平衡时,二甲醚的分解率![]() ,
,![]() ,
,![]() ,平衡常数
,平衡常数 。答案为:
。答案为:![]()
![]() ;
;![]() ;
;![]() ;
;
![]() 升高温度,
升高温度,![]() 的浓度增大,说明平衡逆向移动,所以正向反应是放热反应。
的浓度增大,说明平衡逆向移动,所以正向反应是放热反应。
当反应达到平衡时![]() ,则
,则![]() ;
;![]() K、
K、![]() 时,设起始时
时,设起始时![]() ,则
,则
反应的三段式为

所以![]() ,
,![]() ,所以
,所以![]() 、
、![]() ,
, 。答案为:放热;
。答案为:放热;![]() 。
。


科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
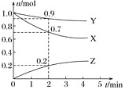
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1.0 mol的HI(g)通入体积为1.0 L的密闭容器中,实验测得HI(g)的最大分解率为22.2%,则该温度下,反应![]() H2(g) +
H2(g) +![]() X2(g)
X2(g)![]() HX(g)平衡常数接近于( )
HX(g)平衡常数接近于( )
A.0.02B.0.15C.7D.49
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向有机聚合物中添加阻燃剂,可增大聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,其生产工艺如图1所示:

请完成下列填空:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],发生反应的化学方程式为___。
(2)合成反应后,继续在393~523K下水热处理8h,发生反应Mg(OH)2-xClxmH2O=(1-![]() )Mg(OH)2+
)Mg(OH)2+![]() MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
(3)阻燃型Mg(OH)2具有晶粒大、易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是___和___。
(4)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g) △H=+81.5kJmol-1
Al(OH)3(s)![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g) △H=+87.7kJmol-1
H2O(g) △H=+87.7kJmol-1
Mg(OH)2和A1(OH)3起阻燃作用的主要原因是:___
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程图2(框内写产物的化学式,箭头上下标明转化条件或操作名称):___、___、___、___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:298K时,四种物质的溶度积如表所示。下列说法正确的是( )
化学式 | CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
Ksp | 2.3×10-3 | 1.56×10-10 | 1.12×10-12 | 6.3×10-50 |
A.298K时,将0.001molL-1的AgNO3溶液逐滴滴入0.001molL-1的KCl和0.001molL-1的K2CrO4的混合液中,则先产生Ag2CrO4沉淀
B.298K时,向2.0×10-4molL-1的K2CrO4溶液中加入等体积的2.0×10-4molL-1的AgNO3溶液,则有Ag2CrO4沉淀生成(忽略混合时溶液体积的变化)
C.298K时,向CH3COOAg悬浊液中加入盐酸,发生反应的离子方程式为CH3COOAg+H++Cl-CH3COOH+AgCl
D.已知:![]() =0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
=0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
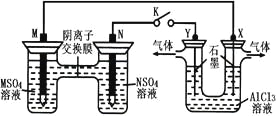
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-=N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是

A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1molO2,则有4mol e-回到电源正极
C. 开关K闭合给锂电池充电,X对应充电电极上的反应为Li++e-=Li
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(K2NCONH2)的化学能直接转化为电能,并生成对环境无害物质的装罝;同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A. H+透过质子交换膜由右向左移动
B. 铜电极应与X相连接
C. M电极反应式:H2NCONH2+H2O-6e-== CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铁电极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:
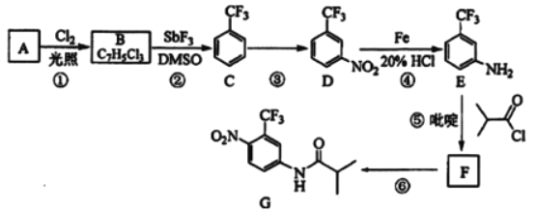
回答下列问题:
(1)A的结构简式为__。C的化学名称是__。
(2)③的反应试剂和反应条件分别是__,该反应的类型是__。
(3)⑤的反应方程式为__。吡啶是一种有机碱,其作用是__。
(4)G的分子式为__。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__种。
(6)4甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com