
【题目】已知:298K时,四种物质的溶度积如表所示。下列说法正确的是( )
化学式 | CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
Ksp | 2.3×10-3 | 1.56×10-10 | 1.12×10-12 | 6.3×10-50 |
A.298K时,将0.001molL-1的AgNO3溶液逐滴滴入0.001molL-1的KCl和0.001molL-1的K2CrO4的混合液中,则先产生Ag2CrO4沉淀
B.298K时,向2.0×10-4molL-1的K2CrO4溶液中加入等体积的2.0×10-4molL-1的AgNO3溶液,则有Ag2CrO4沉淀生成(忽略混合时溶液体积的变化)
C.298K时,向CH3COOAg悬浊液中加入盐酸,发生反应的离子方程式为CH3COOAg+H++Cl-CH3COOH+AgCl
D.已知:![]() =0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
=0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,计算下列溶液的pH,并将计算结果填在横线上:
(1)c(OH-)=1×10-4mol·L-1的溶液_______________。
(2)将0.1 mol HCl溶于水制成100 mL溶液______________。
(3)将pH=2的HCl溶液和pH=2的H2SO4溶液以体积比3∶1混合_____________。
(4)将0.23 g金属钠溶于水并配制成100 mL的溶液_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L 1 mol·L-1的氨水中,下列说法正确的是( )
A.含1 mol NH3·H2OB.含1 mol![]() 和OH-
和OH-
C.含![]() 和NH3·H2O的和为1 molD.含NH3、NH3·H2O、
和NH3·H2O的和为1 molD.含NH3、NH3·H2O、![]() 之和为1 mol
之和为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是
A. 辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为 2,2,3-三甲基戊酸
B. 辛酸的羧酸类同分异构体中,含有3个“一CH3”结构,且存在乙基支链的共有7种(不考虑立体异构)
C. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种(不考虑立体异构)
D. 正辛酸常温下呈液态,而软脂酸常温下呈固态,故二者不符合同一通式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。请回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的△H=________
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=___
molL-1min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为___,该温度下平衡常数K=___。
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___反应(填“放热”或“吸热”)。
在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时,![]() =___。
=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )

A.![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B.![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C.![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解图池中的溶液。已知铅蓄电池的总反应为Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。电解一段时间后,发现a极上析出红色固体物质,下列说法正确的是( )
2PbSO4(s)+2H2O(l)。电解一段时间后,发现a极上析出红色固体物质,下列说法正确的是( )
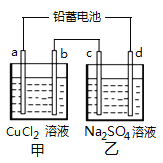
A. d极为阴极
B. 若利用甲池精炼铜,b极应为粗铜
C. 放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+SO![]() (aq)+2e- =PbSO4(s)+2H2O(l)
(aq)+2e- =PbSO4(s)+2H2O(l)
D. 若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知A和B均为第3周期元素,其原子的第一至第四电离能如下表所示:
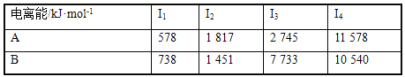
A通常显___价,A的电负性____B的电负性(填“>”“<”或“=”)。
(2)紫外光的光子所具有的能量约为399kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因_____。
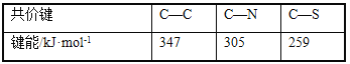
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是____。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
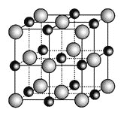
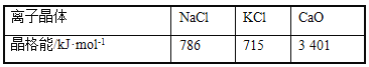
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:____。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有____个。
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是____。
(5)某配合物的分子结构如图所示,其分子内不含有___(填序号)。
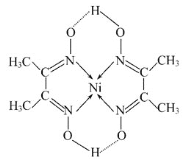
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。若有1molCH4生成,则有___molσ键和___molπ键断裂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com