
【题目】常温下,计算下列溶液的pH,并将计算结果填在横线上:
(1)c(OH-)=1×10-4mol·L-1的溶液_______________。
(2)将0.1 mol HCl溶于水制成100 mL溶液______________。
(3)将pH=2的HCl溶液和pH=2的H2SO4溶液以体积比3∶1混合_____________。
(4)将0.23 g金属钠溶于水并配制成100 mL的溶液_______________。
【答案】10 0 2 13
【解析】
常温下,水的离子积常数KW=10-14,pH=-lgc(H+),据此计算。
(1)c(OH-)=1×10-4mol·L-1的溶液,c(H+)=![]() mol/L,pH=-lg10-10=10。答案为:10;
mol/L,pH=-lg10-10=10。答案为:10;
(2)将0.1 mol HCl溶于水制成100 mL溶液,c(H+)=![]() =1mol/L,pH=-lg1=0。答案为:0;
=1mol/L,pH=-lg1=0。答案为:0;
(3)将pH=2的HCl溶液和pH=2的H2SO4溶液以体积比3∶1混合,c(H+)=![]() =10-2mol/L,pH=-lg10-2=2。答案为:2;
=10-2mol/L,pH=-lg10-2=2。答案为:2;
(4)将0.23 g金属钠溶于水,生成0.01molNaOH,并配制成100 mL的溶液,c(OH-)=![]() =0.1mol/L,c(H+)=10-13mol/L,pH=-lg10-13=13。答案为:13。
=0.1mol/L,c(H+)=10-13mol/L,pH=-lg10-13=13。答案为:13。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价有+3,+2),设计了如下实验流程:
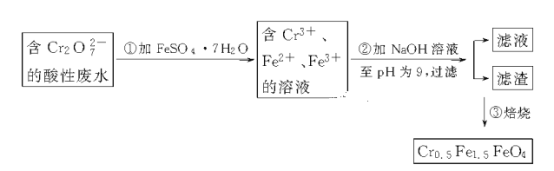
(1)第①步反应的离子方程式是__________________________________________
(2)第②步中用pH试纸测定溶液pH的操作是______________________________
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为______________,加碱调节至pH为________时,铁元素刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是______________________,原因是________________________________________________。
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染.PETG的结构简式如下:
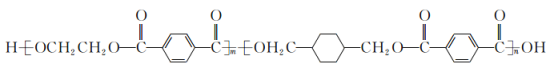
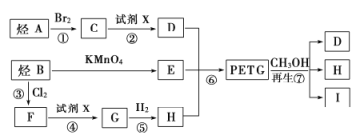
这种材料可采用下图所示的合成路线;
已知;(1)![]()
(2)![]() (R、
(R、![]() 、
、![]() 表示烃基)
表示烃基)
请回答下列问题:
(1)⑦的反应类型是_____________,试剂X为_____________.
(2)写出Ⅰ的结构简式:____________
(3)合成时应控制的单体的物质的量:![]() _____________(用m,n表示).
_____________(用m,n表示).
(4)写出反应②的化学方程式:____________________________________.
(5)与E的分子式相同,且满足下列条件的同分异构体有_____________种.
①能与![]() 溶液反应产生
溶液反应产生![]() ②能发生银镜反应 ③遇
②能发生银镜反应 ③遇![]() 溶液显紫色
溶液显紫色
(6)D和E在催化剂作用下可生产一种聚酯纤维——涤纶,请写出生产该物质的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中存在化学平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化四氧化二氮的平衡体系,压缩体积后颜色加深
④工业合成氨反应(放热)为加快反应速率,将温度升高到500℃左右
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.①④⑤B.①②③C.②③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )
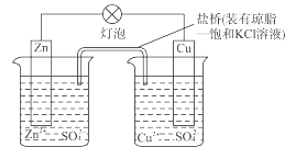
A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
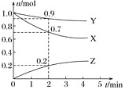
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O↓+3H2O检验醛类。
CH3COONa+Cu2O↓+3H2O检验醛类。
(1)Cu2+基态核外电子排布式为___。
(2)CH3COONa中碳原子轨道的杂化类型是___,1molCH3COONa中含有σ键的数目为___。
(3)与OH-离子互为等电子体的阴离子为__。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为__。
(5)Cu2O晶体结构可能是___(填字母)。

(6)SO32-的空间构型为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:298K时,四种物质的溶度积如表所示。下列说法正确的是( )
化学式 | CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
Ksp | 2.3×10-3 | 1.56×10-10 | 1.12×10-12 | 6.3×10-50 |
A.298K时,将0.001molL-1的AgNO3溶液逐滴滴入0.001molL-1的KCl和0.001molL-1的K2CrO4的混合液中,则先产生Ag2CrO4沉淀
B.298K时,向2.0×10-4molL-1的K2CrO4溶液中加入等体积的2.0×10-4molL-1的AgNO3溶液,则有Ag2CrO4沉淀生成(忽略混合时溶液体积的变化)
C.298K时,向CH3COOAg悬浊液中加入盐酸,发生反应的离子方程式为CH3COOAg+H++Cl-CH3COOH+AgCl
D.已知:![]() =0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
=0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com