
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
【答案】H2SO3>CH3COOH>H2CO3 3% < CO32->SO32->CH3COO->HSO3- HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性。 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性。 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
【解析】
(1)电离平衡常数越大,酸性越强,所以电解质由强到弱的顺序为H2SO3>CH3COOH>H2CO3。
(2)0.02mol·L-1的醋酸在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,设该溶液中醋酸的电离度为x,则醋酸电离出的酸酸根离子、氢离子浓度均为0.02xmol·L-1,醋酸的浓度为0.02(1-x)mol·L-1,根据醋酸的电离平衡常数K=1.8×10-5可知:K=1.8×10-5=
CH3COO-+H+,设该溶液中醋酸的电离度为x,则醋酸电离出的酸酸根离子、氢离子浓度均为0.02xmol·L-1,醋酸的浓度为0.02(1-x)mol·L-1,根据醋酸的电离平衡常数K=1.8×10-5可知:K=1.8×10-5=![]() ,解得:x=3%。由于酸性H2SO3>CH3COOH,同体积、同PH的H2SO3和CH3COOH,加水稀释相同倍数,H2SO3的PH变化大,所以稀释后醋酸的PH小于亚硫酸的PH。故填<。
,解得:x=3%。由于酸性H2SO3>CH3COOH,同体积、同PH的H2SO3和CH3COOH,加水稀释相同倍数,H2SO3的PH变化大,所以稀释后醋酸的PH小于亚硫酸的PH。故填<。
(3)已知酸性:H2SO3>CH3COOH>H2CO3>HSO3->HCO3-,酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱,则CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-。
(4)NaHSO3溶液显酸性的原因是HSO![]() 在溶液中存在电离和水解,即HSO3-
在溶液中存在电离和水解,即HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性。NaHSO3溶液中有五种离子:Na+、HSO3-、H+、SO32-、OH-,Na+和HSO3-是由强电解质NaHSO3电离出来的,是大量的,HSO3-能发生电离和水解,所以Na+浓度大于HSO3-浓度,HSO3-的电离程度大于其水解程度,所以c(H+)>c(OH-),溶液中的H+既有水电离出来的,又有由HSO3-电离出来的,所以c(H+)>c(SO32-),故溶液中离子浓度排序为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性。NaHSO3溶液中有五种离子:Na+、HSO3-、H+、SO32-、OH-,Na+和HSO3-是由强电解质NaHSO3电离出来的,是大量的,HSO3-能发生电离和水解,所以Na+浓度大于HSO3-浓度,HSO3-的电离程度大于其水解程度,所以c(H+)>c(OH-),溶液中的H+既有水电离出来的,又有由HSO3-电离出来的,所以c(H+)>c(SO32-),故溶液中离子浓度排序为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是
①S![]() SO3
SO3![]() H2SO4
H2SO4
②N2![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
③MgCl(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)2
Al(OH)2![]() Al2O2
Al2O2![]() Al
Al
A.①③⑤
B.②③④
C.③④⑤
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5 表示。有关说法正确的是 ( )

A.该装置为原电池,b为原电池的负极
B.a极区溶液的pH减小,中间室Na+移向左室
C. 当左室有4.48L(标准状况下)CO2生成时,右室产生的N2为0.8mol
D.a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,计算下列溶液的pH,并将计算结果填在横线上:
(1)c(OH-)=1×10-4mol·L-1的溶液_______________。
(2)将0.1 mol HCl溶于水制成100 mL溶液______________。
(3)将pH=2的HCl溶液和pH=2的H2SO4溶液以体积比3∶1混合_____________。
(4)将0.23 g金属钠溶于水并配制成100 mL的溶液_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某储氢的碳纳米管二次电池的工作原理如图,该电池的电解质为6 mol·L-1的KOH溶液。下列说法正确的是
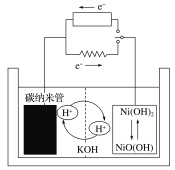
A.放电过程中,碳纳米管的质量一直保持恒重
B.放电时正极附近溶液的pH减小
C.充电时阳极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该二次电池的工作原理为H2+2NiO(OH)![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Al3+、K+、Cl-、SO42-
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是( )
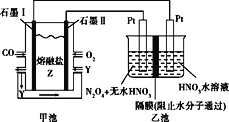
A.石墨Ⅰ是原电池的负极,发生氧化反应
B.乙池中,若使用质子交换膜,每生成1molN2O5,则有2mol H+通过交换膜进入右室
C.石墨II的电极反应式:O2+2CO2+4e-=2CO32-
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L 1 mol·L-1的氨水中,下列说法正确的是( )
A.含1 mol NH3·H2OB.含1 mol![]() 和OH-
和OH-
C.含![]() 和NH3·H2O的和为1 molD.含NH3、NH3·H2O、
和NH3·H2O的和为1 molD.含NH3、NH3·H2O、![]() 之和为1 mol
之和为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )

A.![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B.![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C.![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com