
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Al3+、K+、Cl-、SO42-
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
科目:高中化学 来源: 题型:
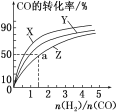
【题目】(1)工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g) ===CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是__________。
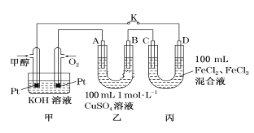
(2)如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
Ⅰ.甲中负极的电极反应式为__________________________。
Ⅱ.乙中反应的化学方程式为_________________________________;A极析出的气体在标准状况下的体积为________。
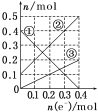
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要______ mL 5.0 mol·L-1 NaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中存在化学平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化四氧化二氮的平衡体系,压缩体积后颜色加深
④工业合成氨反应(放热)为加快反应速率,将温度升高到500℃左右
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.①④⑤B.①②③C.②③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
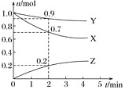
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25mL0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
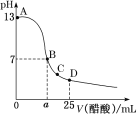
A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离常数K=![]()
C.C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O↓+3H2O检验醛类。
CH3COONa+Cu2O↓+3H2O检验醛类。
(1)Cu2+基态核外电子排布式为___。
(2)CH3COONa中碳原子轨道的杂化类型是___,1molCH3COONa中含有σ键的数目为___。
(3)与OH-离子互为等电子体的阴离子为__。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为__。
(5)Cu2O晶体结构可能是___(填字母)。

(6)SO32-的空间构型为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1.0 mol的HI(g)通入体积为1.0 L的密闭容器中,实验测得HI(g)的最大分解率为22.2%,则该温度下,反应![]() H2(g) +
H2(g) +![]() X2(g)
X2(g)![]() HX(g)平衡常数接近于( )
HX(g)平衡常数接近于( )
A.0.02B.0.15C.7D.49
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是

A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1molO2,则有4mol e-回到电源正极
C. 开关K闭合给锂电池充电,X对应充电电极上的反应为Li++e-=Li
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com