
【题目】某储氢的碳纳米管二次电池的工作原理如图,该电池的电解质为6 mol·L-1的KOH溶液。下列说法正确的是
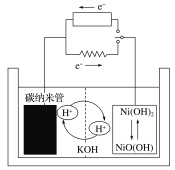
A.放电过程中,碳纳米管的质量一直保持恒重
B.放电时正极附近溶液的pH减小
C.充电时阳极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该二次电池的工作原理为H2+2NiO(OH)![]() 2Ni(OH)2
2Ni(OH)2
【答案】D
【解析】
放电时相当于是原电池,充电时相当于是电解池,结合原电池、电解池的工作原理和装置图分析解答。
A、放电过程相当于是原电池,利用图示可知放电时储有氢气的碳纳米管中H2失电子发生氧化反应:H2-2e-+2OH-=2H2O,放电过程中,碳纳米管的质量不断减少,A项错误;
B、放电时正极上NiO(OH)得电子发生还原反应:NiO(OH)+e-+H2O=Ni(OH)2+OH-,因此放电时正极附近溶液的pH增大,B项错误;
C、充电时相当于是电解池,阳极应发生氧化反应,充电时阳极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O,C项错误;
D、将正、负极的电极反应式相加可知电池工作原理为H2+2NiO(OH)![]() 2Ni(OH)2,D项正确。
2Ni(OH)2,D项正确。
答案选D。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br-
B.SO42-
C.H2SO3
D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
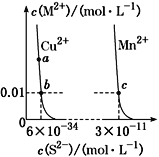
A. 在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=1∶2×10-23
B. 向CuSO4溶液中加入MnS发生反应:
Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)
CuS(s)+Mn2+(aq)
C. a点对应的Ksp等于b点对应的Ksp
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )
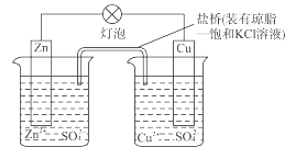
A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号: B__________,C __________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)E元素的正三价离子的电子排布式为____________________________________。
(5)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式____________________。
(6)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是

A. 装置中存在“化学能→电能→光能”的转化
B. 铜片上发生的反应为2H++2e-=H2↑
C. 锌片是负极,其质量逐渐减小
D. 如果将稀硫酸换成稀盐酸,则导线中不会有电子流动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O=2Cr2O42-(黄色)+2H+。请回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是___。
(2)为探究(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,按如图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是___。
②C的作用是___。
③反应结束后,依然要通一段时间的氮气的原因是___。
④加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量的变化分别为200g、1.44g,写出重铬酸铵加热分解反应的化学方程式:___。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为 2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H滴定时,1mo1(CH2)N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL2.000 mo1L-1的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200mo1L-1NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为20.00mL。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去的NaOH标准溶液的体积___(填“偏大”“偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com