
����Ŀ����֪A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵���������������л�̬Aԭ�Ӽ۵����Ų�ʽΪnsnnpn+1��������B2EΪ���ӻ����Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʳ���������̫���ܵ�غͼ��ɵ�·оƬ��Fԭ��������������B����ͬ��������ڲ������������ӣ������������Ϣ���ش��������⣨������Ӧ��Ԫ�ط��ű�ʾ���� 
��1��A��B��E�ĵ�һ��������С�����˳��Ϊ ��
��2���⻯��A2H4������Aԭ�Ӳ�ȡ�ӻ���
��3����ԭ�ӵ���Χ�����Ų�������Ԫ��F��������̬Fԭ�ӵĵ����Ų�ʽΪ ��
��4��Ԫ��A��C���γ�һ�����ͻ�������ϣ��侧����кܸߵ�Ӳ�Ⱥ��۵㣬�仯�����������Ļ�ѧ������Ϊ ��
��5��A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ������A�ԩ�3�ۣ�ÿ�������ʾ1��ԭ�ӣ������仯ѧʽΪ �� �谢���ӵ�����ΪNA �� �������������Fԭ�ӵĺ˼��Ϊa cm����þ������ܶ�Ϊ���ú�a��NA�Ĵ���ʽ��ʾ��g/cm3 ��
���𰸡�
��1��Na��S��N
��2��sp3
��3��ds��1s22s22p63s23p63d104s1��[Ar]3d104s1
��4�����ۼ�
��5��Cu3N��![]()
���������⣺A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵���������������л�̬Aԭ�Ӽ۵����Ų�ʽΪnsnnpn+1 �� ��n=2����AΪNԪ�أ�Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���Χ�����Ų�Ϊ3s23p4 �� ��EΪSԪ�أ�������B2EΪ���ӻ����B����+1�ۣ�ԭ����������̼��С������BΪNa��CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ���CΪAl��D���ʳ���������̫���ܵ�غͼ��ɵ�·оƬ����DΪSi��Fԭ��������������B����ͬ��������ڲ������������ӣ�ԭ�������������ڵ������ڣ����������Ϊ2+8+18+1=19����FΪCu����1��NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ�ͬ������ԭ�����������һ�����ܳ��������ƣ�ͬ�������϶��µ�һ�����ܼ�С���ʵ�һ�����ܣ�Na��S��N���ʴ�Ϊ��Na��S��N����2���⻯��N2H4����Nԭ���γ�2��N��H����1��N��N����������1�Թ¶Ե��ӣ���Nԭ�Ӳ�ȡsp2 �ӻ����ʴ�Ϊ��sp2����3����ԭ�ӵ���Χ�����Ų�������Ԫ��Cu��ds������̬Cuԭ�ӵĺ����������Ϊ29�����̬ԭ�ӵĺ�������Ų�ʽΪ��1s22 s22p63s23p63d104s1��[Ar]3d104s1 �� �ʴ�Ϊ��ds��1s22 s22p63s23p63d104s1��[Ar]3d104s1����4��Ԫ��N��Al���γ�һ�����ͻ�������ϣ��侧����кܸߵ�Ӳ�Ⱥ��۵㣬�û���������ԭ�Ӿ��壬�仯�����������Ļ�ѧ������Ϊ�����ۼ���
�ʴ�Ϊ�����ۼ�����5��A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ����������������A�ԩ�3�ۣ�ÿ�������ʾ1��ԭ�ӣ���
������С��ɫ����ĿΪ8�� ![]() =1�����ɫ����ĿΪ12��
=1�����ɫ����ĿΪ12�� ![]() =3������N�ԩ�3�ۣ���С��ɫ��ΪNԭ�ӡ����ɫ��ΪCu�����仯ѧʽΪCu3N���谢��٤������ΪNA �� ��������Ϊ
=3������N�ԩ�3�ۣ���С��ɫ��ΪNԭ�ӡ����ɫ��ΪCu�����仯ѧʽΪCu3N���谢��٤������ΪNA �� ��������Ϊ ![]() g���������������Cuԭ�ӵĺ˼��Ϊa cm�����ⳤΪ
g���������������Cuԭ�ӵĺ˼��Ϊa cm�����ⳤΪ ![]() acm��2=
acm��2= ![]() acm����û�����ľ����ܶ�Ϊ��
acm����û�����ľ����ܶ�Ϊ�� 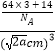 =
= ![]() g/cm3 �� �ʴ�Ϊ��Cu3N��
g/cm3 �� �ʴ�Ϊ��Cu3N�� ![]() ��
��
A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵���������������л�̬Aԭ�Ӽ۵����Ų�ʽΪnsnnpn+1 �� ��n=2����AΪNԪ�أ�Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���Χ�����Ų�Ϊ3s23p4 �� ��EΪSԪ�أ�������B2EΪ���ӻ����B����+1�ۣ�ԭ����������̼��С������BΪNa��CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ���CΪAl��D���ʳ���������̫���ܵ�غͼ��ɵ�·оƬ����DΪSi��Fԭ��������������B����ͬ��������ڲ������������ӣ�ԭ�������������ڵ������ڣ����������Ϊ2+8+18+1=19����FΪCu����1��A��B��E�ֱ���N��Na��SԪ�أ�ͬһ����Ԫ�صĵ�һ����������ԭ�����������������ͬһ���壬Ԫ�صĵ�һ����������ԭ�������������С����2���⻯��N2H4�����У�Nԭ�Ӽ۲���ӶԸ�����4���Ҳ����µ��Ӷԣ��ݴ��ж�Aԭ���ӻ���ʽ����3��F��CuԪ�أ������ڱ���λ��Ϊ�������ڵ�IB�壬�ݴ��ж�������������̬ԭ�ӵĵ����Ų�ʽ����4��Ԫ��N��Al�γ�һ�����ͻ�������ϣ��侧����кܸߵ�Ӳ�Ⱥ��۵㣬˵���û�������ԭ�Ӿ��壬ԭ�Ӿ����к��й��ۼ�����5��N��Cu�γ�ij�ֻ�����ľ����ṹ��ͼ�����þ�̯��ȷ����ѧʽ���������������Fԭ�ӵĺ˼��Ϊa cm�����ⳤΪ ![]() acm��2=
acm��2= ![]() acm���������=��
acm���������=�� ![]() acm��3 �� ���ݦ�=
acm��3 �� ���ݦ�= ![]() ����þ������ܶȣ�
����þ������ܶȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ֹ̼�ظֲ˵����⣬��ʹ�ú��ر����й��̲˺�Ӧ���䣨 ��
A.ϴ��������
B.������ˮ��
C.������ʳ����
D.ֱ�����ڿ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������X�����Y���壬�������·�Ӧ��
X(g)��2Y(g) ![]() Z(g)����Ӧ�����вⶨ�IJ������ݼ��±���
Z(g)����Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
����˵����ȷ���ǣ� ��
A.ǰ10 min�ڷ�Ӧ��ƽ������Ϊv(Z)��0.10 mol��L��1��min��1
B.�¶�Ϊ200��ʱ��������Ӧƽ�ⳣ��Ϊ20��������ӦΪ���ȷ�Ӧ
C.���ܱ���������ɱ䣬�����������䣬�ڴﵽƽ�����С�������Ϊԭ��һ�룬��c(X)��1mol/L
D.���������������䣬���������ٳ���1.00 mol X�����1.20 mol Y���壬����ƽ���Xת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȫʵ����һ�ֳ�������Ȼ���������ԭ���Ǵ���ѹǿ���ͼ�е���ƿ�У��ֱ�����������������ʣ���Ӧ����ܲ�����Ȫ���ǣ� �� 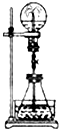
A.Cu��ϡ����
B.NH4HCO3��ϡ����
C.CaCO3��ϡ����
D.NaHCO3��NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ���һ���֣������Ԫ�آ٩�����ͼ�е�λ�ã��û�ѧ����ش��������⣺ 
��1���ܡ��ݡ������Ӱ뾶�ɴ�С��˳��Ϊ ��
��2���ڡ��ۡ��ߵ���ۺ������������ǿ������˳���� ��
��3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ�� ��
��4����ͼ������Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬���������Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� ��
A.MnO2
B.KMnO4
C.Na2SO3
D.FeCl3
��5���ڡ��ۡ��ܵ���̬�⻯����ȶ�����ǿ������˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F��һ�־���ǿ˫�������ʵ����ʣ�����ͨ�����·����ϳɣ�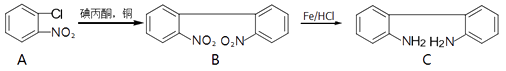

��1����A��B��C��D��F�еĺ�������������Ϊ��
��2��A��B�ķ�Ӧ����Ϊ��
��3��E�ķ�����ΪC14H13N��д��E�Ľṹ��ʽ��
��4��д��ͬʱ��������������F��һ��ͬ���칹��Ľṹ��ʽ��
���ܷ���������Ӧ��
�ں���  �ṹ��
�ṹ��
�۷�����ֻ��6�ֲ�ͬ��ѧ�������⡣
��5����֪�� ![]() ���Ա����Ҷ���Ϊԭ���Ʊ�1,2�������Ҷ�����
���Ա����Ҷ���Ϊԭ���Ʊ�1,2�������Ҷ����� 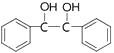 ����д���Ʊ��ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
����д���Ʊ��ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Դ�����ǣ� ��
A.����������
B.�����������糧
C.�����ռ��ͻ������÷�����
D.���վɵ��Ӳ�Ʒ�����伯�зֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ƿ����ձ��У����뼸��ˮ��������ȣ�Ȼ���ټ�������Ũ���ᣬѸ�ٽ��裬�ų��������ȣ�ͬʱ�۲쵽������ڣ�������ͣ��������̼�����ζ�����壮��������ʵ������˵��Ũ����������� ������ţ���ͬ����Ũ����¶�ÿ������������� �� ��������ʢ��Ũ���� �� �ȵ�Ũ�����ͭ��Ӧ �� �٣�ǿ�������� ����ˮ�� ����ˮ�� �����ԣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A��B��C��D��E��X������ͼת����ϵ����֪A��B��C��D����ɫ��Ӧ���ʻ�ɫ������AΪ���ʣ�X�dz�������ɫ��ζ���壮������������ͷ�Ӧ������ȥ����ش�
��1����ɵ���A��Ԫ�ط���Ϊ �� E�ĵ���ʽ ��
��2��д����Cת��ΪD�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com