
����Ŀ����ͼΪԪ�����ڱ���һ���֣������Ԫ�آ٩�����ͼ�е�λ�ã��û�ѧ����ش��������⣺ 
��1���ܡ��ݡ������Ӱ뾶�ɴ�С��˳��Ϊ ��
��2���ڡ��ۡ��ߵ���ۺ������������ǿ������˳���� ��
��3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ�� ��
��4����ͼ������Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬���������Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� ��
A.MnO2
B.KMnO4
C.Na2SO3
D.FeCl3
��5���ڡ��ۡ��ܵ���̬�⻯����ȶ�����ǿ������˳���� ��
���𰸡�
��1��O2����Na+��Al3+
��2��HNO3��H2CO3��H2SiO4
��3��![]() ��
�� ![]()
��4��AD
��5��H2O��NH3��CH4
���������⣺��Ԫ�����ڱ���λ�ÿ�֪����ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����ΪS����ΪCl����1���ܡ��ݡ������Ӱ뾶�ɴ�С��˳��ΪO2����Na+��Al3+ �� ���Դ��ǣ�O2����Na+��Al3+����2���ڢ���C��Si����ͬ����Ԫ�أ�����Ԫ�������ɣ����ϵ�������������Ӧˮ���������������H2CO3��H2SiO3 �� ��ΪN���ǽ���N��C��Ԫ�صķǽ�����Խǿ����Ӧ�ĸ��������Ӧˮ���������Խǿ���������ԣ�HNO3��H2CO3 �� ���Դ��ǣ�HNO3��H2CO3��H2SiO4����3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ������NaOH��NaClO�ȣ���Ӧ�ĵ���ʽ�ֱ�Ϊ ![]() ��
�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ����4�����������ڶ������̻��Ȼ����������·ֽ�����������B��C����������ⷢ��������ԭ��Ӧ�����Դ��ǣ�AD����5���ǽ�����O��N��C����Ӧ�⻯����ȶ���ΪH2O��NH3��CH4 �� ���Դ��ǣ�H2O��NH3��CH4 ��
����4�����������ڶ������̻��Ȼ����������·ֽ�����������B��C����������ⷢ��������ԭ��Ӧ�����Դ��ǣ�AD����5���ǽ�����O��N��C����Ӧ�⻯����ȶ���ΪH2O��NH3��CH4 �� ���Դ��ǣ�H2O��NH3��CH4 ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��W��X��Y��Z��ԭ��������������W��X�ļ����Ӿ�����ͬ���Ӳ�ṹ��X��ԭ�Ӱ뾶�Ƕ���������Ԫ��ԭ�������ģ�W��Yͬ�壬Z��X�γɵ����ӻ������ˮ��Һ�����ԣ�����˵����ȷ���ǣ� ��
A.�����Ӱ뾶��W��X��Z
B.W��X�γɵĻ���������ˮ����Һ�ʼ���
C.��̬�⻯������ȶ��ԣ�W��Y
D.����������ˮ��������ԣ�Y��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ���һ���֣������Ԫ�آ٩�����ͼ�е�λ�ã��û�ѧ����ش��������⣺ 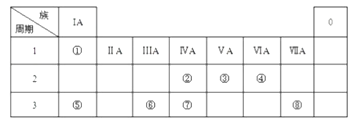
��1���ܡ��ݡ������Ӱ뾶�ɴ�С��˳��Ϊ ��
��2���ڡ��ۡ��ߵ���ۺ������������ǿ������˳���� ��
��3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ�� ��
��4����ͼ������Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬���������Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� ��
A.MnO2
B.KMnO4
C.Na2SO3
D.FeCl3
��5���ڡ��ۡ��ܵ���̬�⻯����ȶ�����ǿ������˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.ʯ������̼������Һ��Ӧ��Ca2++CO32��=CaCO3��
B.NH4HSO3��Һ������������������Һ��ϼ��ȣ�NH4++HSO3��+2OH�� ![]() NH3��+SO32��+2H2O
NH3��+SO32��+2H2O
C.����������KIO3��Һ��KI��Һ������Ӧ����I2��IO3��+5I��+3H2O=3I2+6OH��
D.AgNO3��Һ�м�������İ�ˮ��Ag++NH3?H2O=AgOH��+NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.������̼��������Һ��Ӧ��C6H5OH+HCO3����C6H5O��+CO2��+H2O
B.������ת�����Ҵ���C2H5Br+OH�� ![]() C2H5OH+Br��
C2H5OH+Br��
C.����Һ������C17H35COO��+H+��C17H35COOH
D.��ȩ��Һ������������Cu��OH��2���ȣ�HCHO+2Cu��OH��2+OH�� ![]() HCOO��+Cu2O��+3H2O
HCOO��+Cu2O��+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵���������������л�̬Aԭ�Ӽ۵����Ų�ʽΪnsnnpn+1��������B2EΪ���ӻ����Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʳ���������̫���ܵ�غͼ��ɵ�·оƬ��Fԭ��������������B����ͬ��������ڲ������������ӣ������������Ϣ���ش��������⣨������Ӧ��Ԫ�ط��ű�ʾ���� 
��1��A��B��E�ĵ�һ��������С�����˳��Ϊ ��
��2���⻯��A2H4������Aԭ�Ӳ�ȡ�ӻ���
��3����ԭ�ӵ���Χ�����Ų�������Ԫ��F��������̬Fԭ�ӵĵ����Ų�ʽΪ ��
��4��Ԫ��A��C���γ�һ�����ͻ�������ϣ��侧����кܸߵ�Ӳ�Ⱥ��۵㣬�仯�����������Ļ�ѧ������Ϊ ��
��5��A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ������A�ԩ�3�ۣ�ÿ�������ʾ1��ԭ�ӣ������仯ѧʽΪ �� �谢���ӵ�����ΪNA �� �������������Fԭ�ӵĺ˼��Ϊa cm����þ������ܶ�Ϊ���ú�a��NA�Ĵ���ʽ��ʾ��g/cm3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ���ܴﵽ������ʵ��Ŀ���ǣ� �� 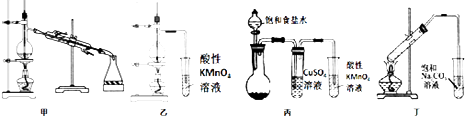
A.����װ�üȿ��Խ���ʯ�͵ķ���Ҳ���Խ��оƾ���Ũ��
B.����װ���ҿ������ʵ�����Ʊ���ϩ���岢������ϩ���������
C.����װ�ñ��������ʵ�����Ʊ���Ȳ���岢������Ȳ���������
D.����װ�ö��������ʵ�����Ʊ������������ռ���Ϊ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�أ�SOFC���Թ�����������Ϊ����ʣ��乤��ԭ����ͼ��ʾ�����й��ڹ���ȼ�ϵ�ص��й�˵����ȷ���ǣ� �� 
A.�缫bΪ��ظ������缫��ӦʽΪ2O2+4e��=4O2��
B.������������������õ����ڵ����ͨ��
C.��H2��Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪH2+2OH����4e��=2H++H2O
D.��C2H4��Ϊȼ��������Ӵ����Ϸ����ķ�ӦΪC2H4+6O2����12e��=2CO2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����д��ȷ���ǣ� ��
A.����ʯ�����ᷴӦ��CO ![]() +2H+�TCO2��+H2O
+2H+�TCO2��+H2O
B.ͭ����������Һ��Ӧ��Cu+Ag+�TCu2++Ag
C.��������ˮ��Cl2+H2O�T2H++Cl��+ClO��
D.����������������Һ��Ӧ��2H++SO ![]() +Ba2++2OH���TBaSO4��+2H2O
+Ba2++2OH���TBaSO4��+2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com