
【题目】用下列实验装置能达到所述的实验目的是( ) 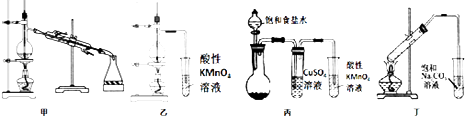
A.利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩
B.利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成
C.利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成
D.利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 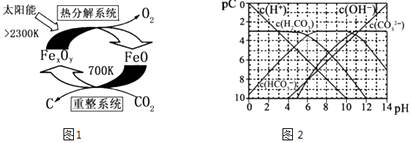
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,请参照元素①﹣⑧在图中的位置,用化学用语回答下列问题: 
(1)④、⑤、⑥的离子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由图中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,可使用的催化剂为(填序号) .
A.MnO2
B.KMnO4
C.Na2SO3
D.FeCl3
(5)②、③、④的气态氢化物的稳定性由强到弱的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( ) 
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第IA族 B.第四周期第IA族
C.第三周期第ⅡA族 D.第四周期第ⅡA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com