
【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .
【答案】
(1)0.6
(2)<
(3)放热;Ka=Kb>Kc
(4)①③④⑤⑥
(5)2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol
【解析】解:(1)p2、T2时,0~lmin 内,CO的转化率是0.5,则参加反应的n(CO)=(10﹣7)mol=3mol,则v(CO)= ![]() =0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2)=2v(CO)=2×0.3mol/(L.min)=0.6mol/(L.min),
=0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2)=2v(CO)=2×0.3mol/(L.min)=0.6mol/(L.min),
所以答案是:0.6;(2)相同温度下,该反应的正反应是反应前后气体体积减小的可逆反应,增大压强平衡正向移动,CO的转化率增大,根据图知,相同温度下CO的转化率P1<P2 , 所以答案是:<; (3)升高温度,CO的转化率降低,说明平衡逆向移动,则正反应是放热反应,所以△H<0,
该反应的正反应是放热反应,升高温度平衡常数减小,AB温度相同且小于C,所以平衡常数Ka=Kb>Kc ,
所以答案是:放热;Ka=Kb>Kc;(4)能增加单位时间内CH3OH产量,说明增大正逆反应速率,可以通过增大反应物浓度、减小生成物浓度、升高温度、加入催化剂、增大压强等方法实现,
故选①③④⑤⑥;(5)碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g)△H=﹣Q1kJ/mol ①
碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,其热化学方程式为C(s)+ ![]() O2(g)=CO(g)△H=﹣Q2kJ/mol ②
O2(g)=CO(g)△H=﹣Q2kJ/mol ②
将方程式2(②﹣①)得2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol,
所以答案是:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1﹣Q2)kJ/mol.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】工业上以1,3﹣丁二烯,丙烯,乙炔等为原料合成 ![]() 流程图如图
流程图如图 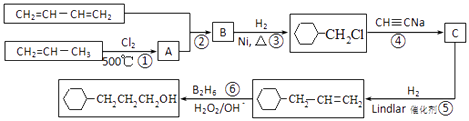
(1)反应①的反应类型是 , B中含有的官能团的名称 .
(2)写出反应②的化学方程式 .
(3)写出C的结构简式 .
(4)写出 ![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
(5)根据以上合成信息,以乙烯为原料合成1,6﹣己二醇,其他试剂任选,写出合成的流程图 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.苯酚与碳酸氢钠溶液反应:C6H5OH+HCO3﹣→C6H5O﹣+CO2↑+H2O
B.溴乙烷转化成乙醇:C2H5Br+OH﹣ ![]() C2H5OH+Br﹣
C2H5OH+Br﹣
C.肥皂液加入醋酸:C17H35COO﹣+H+→C17H35COOH
D.甲醛溶液与足量的新制Cu(OH)2共热:HCHO+2Cu(OH)2+OH﹣ ![]() HCOO﹣+Cu2O↓+3H2O
HCOO﹣+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置能达到所述的实验目的是( ) 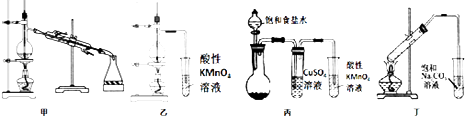
A.利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩
B.利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成
C.利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成
D.利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为 .
(2)汽车等的安全气囊强烈碰撞时爆炸,发生的反应如后: 10NaN3+2KNO3=K2O+5Na2O+16N2↑下列判断正确的是
A.每生成8molN2转移15mol电子
B.NaN3中氮元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1:15
(3)某化学兴趣小组希望能较长时间观察到白色絮状 Fe(OH)2的生成,用FeSO4(用铁粉与稀硫酸反应制得)和过量NaOH溶液反应制Fe(OH)2的装置示意图如图所示.回答下列问题:
(i)A装置的名称是;在生成Fe(OH)2的装置中,发生的主要反应的离子方程式有
(ii)实验时首先打开活塞3,关闭活塞2,其目的是 .
(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为 .
(iv)若在C中加入的是NH4HCO3时,反应时有气体产生,则最主要的离子方程式将是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示:下列关于固体燃料电池的有关说法正确的是( ) 
A.电极b为电池负极,电极反应式为2O2+4e﹣=4O2﹣
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH﹣﹣4e﹣=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2﹣﹣12e﹣=2CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(6)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物中碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的
(4)在B,C,E,F,G,H中,原子半径最大的是
(5)A和D组成化合物的电子式
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
A. X的最高价含氧酸的分子式可表示为H3XO4
B. X是第二周期第ⅤA族元素
C. X是第二周期第ⅥA族元素
D. X的最高正化合价为+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,不考虑混合后溶液体积的变化,下列说法错误的是( )
A.0.1mol?L﹣1CH3COOH溶液加水稀释后,溶液中 ![]() 的值增大
的值增大
B.pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1%
C.amol?L﹣1H2C2O4溶液与2amol?L﹣1的NaOH溶液等体积混合后,c(C2O42﹣)>c(HC2O4﹣)>c(H2C2O4)>c(OH﹣)
D.0.1mol?L﹣1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com