
【题目】根据题意填空
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为 .
(2)汽车等的安全气囊强烈碰撞时爆炸,发生的反应如后: 10NaN3+2KNO3=K2O+5Na2O+16N2↑下列判断正确的是
A.每生成8molN2转移15mol电子
B.NaN3中氮元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1:15
(3)某化学兴趣小组希望能较长时间观察到白色絮状 Fe(OH)2的生成,用FeSO4(用铁粉与稀硫酸反应制得)和过量NaOH溶液反应制Fe(OH)2的装置示意图如图所示.回答下列问题:
(i)A装置的名称是;在生成Fe(OH)2的装置中,发生的主要反应的离子方程式有
(ii)实验时首先打开活塞3,关闭活塞2,其目的是 .
(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为 .
(iv)若在C中加入的是NH4HCO3时,反应时有气体产生,则最主要的离子方程式将是 .
【答案】
(1)2BrO3﹣+10I﹣+12H+=5I2+Br2+6H2O
(2)D
(3)分液漏斗;H++OH﹣=H2O;Fe2++2 OH﹣=Fe(OH)2↓;排出装置中的空气,防止+2价铁被氧化;4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3;Fe 2++2HCO3﹣=FeCO3↓+CO2↑+H2O
【解析】解:(1)在Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O物质中,KBrO2中溴处于高价态,将碘离子氧化成碘单质,反应的离子方程式为:2BrO3﹣+10I﹣+12H+=5I2+Br2+6H2O,所以答案是:2BrO3﹣+10I﹣+12H+=5I2+Br2+6H2O;(2)A.由反应可知,2molKNO3反应转移电子为2mol×(5﹣0)=10mol,即每生成16 mol N2转移10 mol电子,所以每生成8molN2转移5mol电子,故A错误;
B.NaN3中N元素化合价升高,失去电子被氧化,故B错误;
C.只有N元素的化合价变化,则N2既是氧化产物又是还原产物,故C错误;
D.该反应中10molNaN3是还原剂,生成氧化产物N2的物质的量是15mol;2molKNO3是氧化剂,生成还原产物N2的物质的量是1mol,还原产物与氧化产物质量之比为1:15,故D正确;故选D;(3)(i)A装置的名称是分液漏斗;在生成Fe(OH)2的装置中,发生的主要反应氢氧化钠首先中和过量的酸,然后与亚铁离子发生复分解反应生成氢氧化亚铁,所以反应的离子方程式为:H++OH﹣=H2O;Fe2++2 OH﹣=Fe(OH)2↓,所以答案是:H++OH﹣=H2O;Fe2++2 OH﹣=Fe(OH)2↓;(ii)实验时首先打开活塞3,关闭活塞2,是为了排出装置中的空气,防止+2价铁被氧化,所以答案是:排出装置中的空气,防止+2价铁被氧化;(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3 , 所以答案是:4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3
;(iv)若在C中加入的是NH4HCO3时,是碳酸氢根离子与亚铁离子发生双水解,生成二氧化碳气体,离子反应方程式为:Fe 2++2HCO3﹣=FeCO3↓+CO2↑+H2O,所以答案是:Fe 2++2HCO3﹣=FeCO3↓+CO2↑+H2O.


科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是 .
A.SO32﹣和NO2﹣
B.NO3﹣和SO3
C.H3O+和ClO3﹣
D.PO43﹣和SO32﹣
(2)CaF2的晶胞如图所示. 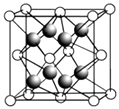
①下列有关CaF2的表达正确的是
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示,已知[AlF6]3﹣在溶液中可稳定存在).
③晶胞中F﹣的配位数是 , 与一个Ca2+等距离且最近的Ca2+有个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJmol﹣1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
④写出Cu原子核外电子排布式;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,5二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) /g·cm—3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5—二甲氧基苯酚 |
| 33~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是。
②萃取时使用的主要仪器为。分离出该容器中的有机层的操作是。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。减压过滤完成后应先拆去连接抽气泵和吸滤瓶的橡皮管再关闭抽气泵,其目的是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( ) 
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+ ![]() O2(g)═ZnO(s)△H=﹣348.3kJmol﹣1 , (2)2Ag(s)+
O2(g)═ZnO(s)△H=﹣348.3kJmol﹣1 , (2)2Ag(s)+ ![]() O2(g)═Ag2O(s)△H=﹣31.0kJmol﹣1 , 则Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H等于( )
O2(g)═Ag2O(s)△H=﹣31.0kJmol﹣1 , 则Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H等于( )
A.﹣379.3kJmol﹣1
B.﹣317.3kJmol﹣1
C.﹣332.8kJmol﹣1
D.317.3kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 .
(2)由A、B、C形成的ABC分子中,含有个σ键,个π键;
(3)下列叙述正确的是 . (填字母)
a.M易溶于水,是因为M与水分子间能形成氢键,且M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(4)E的一种氧化物Q,其晶胞结构如下图所示,则Q的化学式为 , 该晶体中氧原子的配位数为 . 
(5)B、C、D三种元素的第一电离能由小到大的顺序为 .
(6)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl36H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为 .
(2)汽车等的安全气囊强烈碰撞时爆炸,发生的反应如后: 10NaN3+2KNO3=K2O+5Na2O+16N2↑下列判断正确的是
A.每生成8molN2转移15mol电子
B.NaN3中氮元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1:15
(3)某化学兴趣小组希望能较长时间观察到白色絮状 Fe(OH)2的生成,用FeSO4(用铁粉与稀硫酸反应制得)和过量NaOH溶液反应制Fe(OH)2的装置示意图如图所示.回答下列问题:
(i)A装置的名称是;在生成Fe(OH)2的装置中,发生的主要反应的离子方程式有
(ii)实验时首先打开活塞3,关闭活塞2,其目的是 .
(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为 .
(iv)若在C中加入的是NH4HCO3时,反应时有气体产生,则最主要的离子方程式将是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com