
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 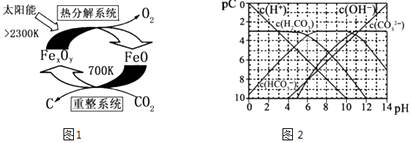
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
【答案】
(1)CH4(g)+ ![]() O2(g)?CH3OH(l)△H1=﹣164.0kJ?mol﹣1
O2(g)?CH3OH(l)△H1=﹣164.0kJ?mol﹣1
(2)>;90.9%
(3)Fe3O4;2mol
(4)不能;1×10﹣6;A
【解析】解:(1)有热化学方程式:
①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
根据盖斯定律:①+②+ ![]() ×③得CH4(g)+
×③得CH4(g)+ ![]() O2 (g)CH3OH(l)△H1=﹣164.0kJmol﹣1 .
O2 (g)CH3OH(l)△H1=﹣164.0kJmol﹣1 .
所以答案是:CH4(g)+ ![]() O2 (g)CH3OH(l)△H1=﹣164.0kJmol﹣1
O2 (g)CH3OH(l)△H1=﹣164.0kJmol﹣1
(2)①反应一是吸热反应,温度升高,化学平衡正向移动,k值变大,实验2的温度高于实验3,所以k2>k3
所以答案是:>
②设CH4和H2O的起始量为x,根据三段式:
CH4(g)+ | H2O(g) | CO(g)+ | 3H2(g) | ||
起始量: | x | x | 0 | 0 | |
转化量: | 0.1 | 0.1 | 0.1 | 0.3 | |
平衡量: | x﹣0.1 | x﹣0.1 | 0.1 | 0.3 |
由平衡常数表达式k= ![]() =
= ![]() =27,解得x=0.11,则平衡时甲烷的转化率为:
=27,解得x=0.11,则平衡时甲烷的转化率为: ![]() =90.9%.
=90.9%.
所以答案是: ![]() (90.9%、90.91%、
(90.9%、90.91%、 ![]() ×100%)
×100%)
(3)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO):n(CO2)=6:1,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4 .
所以答案是:Fe 3O4
②热分解系统中是Fe3O4分解为FeO与氧气,分解l mol Fe3O4转移电子的物质的量为 ![]() =2mol.
=2mol.
所以答案是:2mol
(4)①碳酸存在的溶液中酸性较强、碳酸根离子存在的溶液中碱性较强,所以碳酸根离子和碳酸不能大量共存.
所以答案是:不能;
②由图象可知当pH=6时,pC(H2CO3)=pC(HCO3﹣),结合Ka1(H2CO3)= ![]() =
= ![]() =1×10﹣6 .
=1×10﹣6 .
所以答案是:1×10﹣6
③氢离子浓度增大,平衡向左移动放出CO2 , 碳酸浓度基本不变,则c(H+)/c(H2CO3)最终将变大.
所以答案是:A
【考点精析】关于本题考查的化学平衡的计算和弱电解质在水溶液中的电离平衡,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质量×100%;当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能得出正确答案.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.13.5L
B.9.0L
C.16.8L
D.15.7L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常采用煅烧黄铁矿来制备SO2 , 同时产生烧渣.烧渣的主要成分是含铁的氧化物和二氧化硅等,利用烧渣制备高效净水剂聚合硫酸铁可以达到资源综合利用的目的.其工艺流程如图: 
(1)检验“反应I”后的溶液中是否含有Fe3+的试剂是 .
(2)滤渣I的主要成分是 .
(3)“操作III”中具体的方法依次为、、过滤和洗涤.
(4)加入适量H2O2的目的是将Fe2+氧化为Fe3+ , 氧化时需控制反应温度为50~60℃的原因是 ,
(5)生成聚合硫酸铁的过程是先水解再聚合,聚合的化学方程式为mFe2(OH)n(SO4) ![]() [Fe2(OH)n(SO4)
[Fe2(OH)n(SO4) ![]() ]m请写出水解的化学方程式
]m请写出水解的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH﹣═2CO32﹣+6H2O,则下列说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示套实验装置,分别回答下列问题: 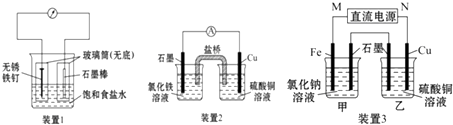
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为 .
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL 0.5molL﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红.
①电源的M端为极,甲烧杯中铁电极的电极反应为;
②乙烧杯中电解反应的离子方程式为;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,则甲烧杯中产生的气体在标准状况下为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以1,3﹣丁二烯,丙烯,乙炔等为原料合成 ![]() 流程图如图
流程图如图 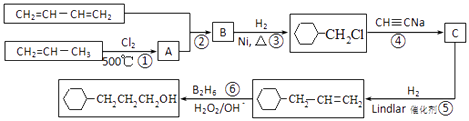
(1)反应①的反应类型是 , B中含有的官能团的名称 .
(2)写出反应②的化学方程式 .
(3)写出C的结构简式 .
(4)写出 ![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
(5)根据以上合成信息,以乙烯为原料合成1,6﹣己二醇,其他试剂任选,写出合成的流程图 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,请参照元素①﹣⑧在图中的位置,用化学用语回答下列问题: 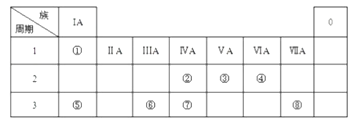
(1)④、⑤、⑥的离子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由图中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,可使用的催化剂为(填序号) .
A.MnO2
B.KMnO4
C.Na2SO3
D.FeCl3
(5)②、③、④的气态氢化物的稳定性由强到弱的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置能达到所述的实验目的是( ) 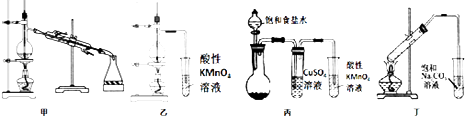
A.利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩
B.利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成
C.利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成
D.利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com