
【题目】如图所示套实验装置,分别回答下列问题: 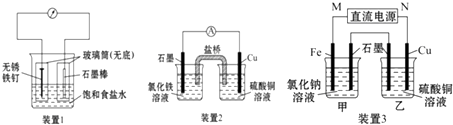
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为 .
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL 0.5molL﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红.
①电源的M端为极,甲烧杯中铁电极的电极反应为;
②乙烧杯中电解反应的离子方程式为;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,则甲烧杯中产生的气体在标准状况下为mL.
【答案】
(1)氧化;O2+4e﹣+2H2O﹣═4OH﹣
(2)正;Cu+2Fe3+=Cu2++2Fe2+
(3)正;Fe﹣2e﹣═Fe2+;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;224
2Cu+O2↑+4H+;224
【解析】解:(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+ , 正极发生还原反应,氧气得到电子被还原生成OH﹣ , 电极方程式为O2+4e﹣+2H2O﹣═4OH﹣ , 所以答案是:氧化;O2+4e﹣+2H2O﹣═4OH﹣;(2)铜可被Fe3+氧化,发生Cu+2Fe3+=Cu2++2Fe2+ , 形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,所以答案是:正;Cu+2Fe3+=Cu2++2Fe2+;(3)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH﹣ , 应为电解池的阴极,则M为正极,N为负极,电解氯化钠溶液,阳极发生氧化反应生成二价铁,电极方程式为 Fe﹣2e﹣═Fe2+ , 所以答案是:正; Fe﹣2e﹣═Fe2+;②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O
2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O ![]() 2Cu+O2↑+4H+;③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
2Cu+O2↑+4H+;③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为 ![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O+ | 2e﹣═ | 2OH﹣+ | H2↑ |
2mol | 22.4L | ||
0.02mol | V |
V= ![]() =0.224L,即224ml,
=0.224L,即224ml,
所以答案是:224.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是金属牺牲阳极的阴极保护法的实验装置,有关说法正确的是( ) 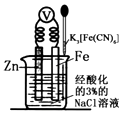
A.该装置为电解池
B.本实验牺牲了金属Fe来保护金属Zn
C.若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀
D.远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,生成71g Cl2转移的电子是__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 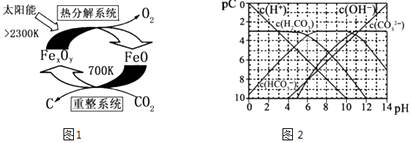
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已严重已严重危害人类的生活.下列对应关系正确的是( )
选项 | 环境问题 | 造成环境问题的主要物质 |
A | 酸雨 | O3 |
B | 温室效应 | CO2 |
C | 南极臭氧层空洞 | SO3 |
D | 光化学烟雾 | N2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向容积为2L的密闭容器中充入一定量的X气体和Y气体,发生如下反应:
X(g)+2Y(g) ![]() Z(g);反应过程中测定的部分数据见下表:
Z(g);反应过程中测定的部分数据见下表:
反应时间/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
下列说法正确的是( )
A.前10 min内反应的平均速率为v(Z)=0.10 mol·L-1·min-1
B.温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应
C.若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L
D.保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com