
����Ŀ����ҵ�ϳ��������ջ��������Ʊ�SO2 �� ͬʱ������������������Ҫ�ɷ��Ǻ�����������Ͷ�������ȣ����������Ʊ���Ч��ˮ���ۺ����������Դﵽ��Դ�ۺ����õ�Ŀ�ģ��乤��������ͼ�� 
��1�����顰��ӦI�������Һ���Ƿ���Fe3+���Լ��� ��
��2������I����Ҫ�ɷ��� ��
��3��������III���о���ķ�������Ϊ�������˺�ϴ�ӣ�
��4����������H2O2��Ŀ���ǽ�Fe2+����ΪFe3+ �� ����ʱ����Ʒ�Ӧ�¶�Ϊ50��60���ԭ���� ��
��5�����ɾۺ��������Ĺ�������ˮ���پۺϣ��ۺϵĻ�ѧ����ʽΪmFe2��OH��n��SO4�� ![]() [Fe2��OH��n��SO4��
[Fe2��OH��n��SO4�� ![]() ]m��д��ˮ��Ļ�ѧ����ʽ
]m��д��ˮ��Ļ�ѧ����ʽ
���𰸡�
��1��KSCN��Һ
��2��SiO2
��3������Ũ������ȴ�ᾧ
��4���¶ȵͣ���Ӧ���������¶ȸߣ�H2O2�ֽ�ӿ죬������������������
��5��Fe2��SO4��3+nH2O?Fe2��OH��n��SO4Fe2��SO4��3+nH2O?Fe2��OH��n��SO4����3�� ![]() ��+
��+ ![]() H2SO4����3��
H2SO4����3�� ![]() ��+
��+ ![]() H2SO4
H2SO4
���������⣺��������������Ҫ�ɷ���Fe3O4��Fe2O3��FeO�Ͷ������裩��������������ܣ�ˮ�������˳���������Ķ������裬��Һ�к����������������������ӷ���Ƥ��Fe�����������ӷ�Ӧ�����������ӣ�����ȥ�������������ҺΪ����������Һ��Ȼ������Ũ������ȴ�ᾧ���õ������������壬�����м�ϡ���ᡢ˫��ˮ�õ��ۺ�����������1�����顰��ӦI�������Һ���Ƿ���Fe3+���Լ���KSCN��Һ������������KSCN��Һ��Ѫ��ɫ����ô�����ӵĴ��ڣ����Դ��ǣ�KSCN��Һ����2����������������Ҫ�ɷ���Fe3O4��Fe2O3��FeO�Ͷ������裩��������������ܣ�ˮ�������˳���������Ķ������裬����I����Ҫ�ɷ���SiO2 �� ���Դ��ǣ�SiO2����3������III��������Һ�õ�����FeSO47H2O������ķ�������Ϊ������Ũ������ȴ�ᾧ�����˺�ϴ�ӣ����Դ��ǣ�����Ũ���������Ũ������ ��ȴ�ᾧ����4����������H2O2��Ŀ���ǽ�Fe2+����ΪFe3+ �� ����ʱ����Ʒ�Ӧ�¶�Ϊ50��60���ԭ����Ϊ�˼ӿ췴Ӧ���ʣ���ֹ��������ֽ⣬��Ϊ�¶ȵͣ���Ӧ���������¶ȸߣ�H2O2�ֽ�ӿ죬�����������������ӣ����Դ��ǣ��¶ȵͣ���Ӧ���������¶ȸߣ�H2O2�ֽ�ӿ죬�����������������ӣ���5�����ɾۺ��������Ĺ�������ˮ���پۺϣ��ۺϵĻ�ѧ����ʽΪmFe2��OH��n��SO4�� ![]() [Fe2��OH��n��SO4��
[Fe2��OH��n��SO4�� ![]() ]m �� ˮ��Ļ�ѧ����ʽΪ��Fe2��SO4��3+nH2OFe2��OH��n��SO4����3��
]m �� ˮ��Ļ�ѧ����ʽΪ��Fe2��SO4��3+nH2OFe2��OH��n��SO4����3�� ![]() ��+
��+ ![]() H2SO4 ��
H2SO4 ��
���Դ��ǣ�Fe2��SO4��3+nH2OFe2��OH��n��SO4����3�� ![]() ��+
��+ ![]() H2SO4 ��
H2SO4 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���A��
����C��H��O����Ԫ����ɣ���ȼ�շ���ʵ��ⶨ��̼������������64.86%���������������13.51%
����ͼ�Ǹ��л��������ͼ��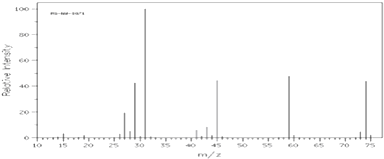
��A�ĺ������ͼ����C��H����O��H����C��O���������շ壮
��A�ĺ˴Ź��������������壮��ش�
��1��A��ʵ��ʽ�����ʽ��Ϊ �� ��Է�������Ϊ ��
��2����֪A�����ʽ�ܷ�ȷ��A�ķ���ʽ����ܡ����ܡ��� �� ������ ��
��3��A�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A�����ĺ����������ͬ��ͬѹ�£�A�������Ҵ�����������ܶ���2��13.8gA��ȫȼ�պ�����ȼ�յIJ���ͨ����ʯ�ң���ʯ�ҵ�����������30.6g������ȼ�ղ���ͨ��Ũ���ᣬŨ���������������10.8g������13.8gA�����������Ƴ�ַ�Ӧ���������������Ϊ5.04L����״������ͨ������ȷ��A����Է�������������ʽ���ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.��ԭ��صĸ����͵��ص������϶��Ƿ���ʧ���ӵ�������Ӧ
B.�ö��Ե缫���Na2SO4��Һ������������������ʵ���֮��Ϊ1��2
C.�ö��Ե缫��ⱥ��NaCl��Һ������1 mol����ת�ƣ�������1mol NaOH
D.�Ʋ������������ȶ�п�������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2KMnO4��16HCl(Ũ)===2KCl��2MnCl2��5Cl2����8H2O������71g Cl2ת�Ƶĵ�����__________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ڹ̶�������ܱ������з������з�Ӧ��2HI��g��=H2��g��+I2��g����c��HI�� ��0.1mol/L ����0.07mol/Lʱ����Ҫ15s����ôc��HI����0.07mol/L����0.05mol/Lʱ�����跴Ӧʱ��Ϊ�� ��
A.����5s
B.����10s
C.����10s
D.��10s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼���仯������ת������Դ�ij�����á���̼����������Ҫ�����ã�
��1����֪����CH4��g��+H2O��g��CO��g��+3H2��g����H1=+206.1kJmol��1
��2H2��g��+CO��g��CH3OH��l����H2=��128.3kJmol��1
��2H2��g��+O2��g��2H2O ��g����H3=��483.6kJmol��1
25��ʱ���ں��ʵĴ��������£����ü��������һ���ϳ�Һ̬�״����Ȼ�ѧ����ʽΪ ��
��2�����÷�Ӧ�����Ʊ�������Ϊ��̽���¶ȡ�ѹǿ�Է�Ӧ�����ʡ�ת���ʵ�Ӱ�죬ijͬѧ�������������Ա�ʵ�飨�¶�Ϊ400���500�棬ѹǿΪ101kPa��404kPa����
ʵ����� | �¶ȡ� | ѹǿ/kPa | CH4��ʼŨ��/molL��1 | H2O��ʼŨ��/molL��1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
��ʵ��2��ʵ��3��ȣ���ƽ�ⳣ����ϵ��K2K3�����������������=������
�ڽ������ʵ�����CH4��ˮ��������1L�����ܱ������У�����������Ӧ����400���´ﵽƽ�⣬ƽ�ⳣ��K=27����ʱ������CO���ʵ���Ϊ0.10mol����CH4��ת����Ϊ ��
��3����ѧ�������CO2�� ȡ C��̫���ܹ�����ͼ1��ʾ��
�١�����ϵͳ�������ķ�Ӧ��n��FeO����n��CO2��=6��1����Fe xOy�Ļ�ѧʽΪ ��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�l mol Fe xOy �� ת�Ƶ��ӵ����ʵ���Ϊ �� 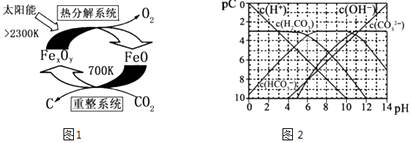
��4��pC����pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ø�����ֵ����ij��Һ�����ʵ�Ũ��Ϊ1��10��3molL��1 �� �����Һ�����ʵ�pC=��lg��1��10��3��=3����ͼ2Ϊ25��ʱH2CO3��Һ��pC��pHͼ����ش��������� ��������Ũ��С��10��5mol/L������Ϊ�����Ӳ����ڣ���
����ͬһ��Һ�У�H2CO3��HCO3����CO32������ܡ����ܡ����������森
����H2CO3һ������ƽ�ⳣ������ֵKa1= ��
������ѪҺ����Ҫͨ��̼�����λ�����ϵ ![]() ���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�
���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е� ![]() ���ս� ��
���ս� ��
A�����B����СC����������D�����жϣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com