
下列物质水溶液吸收SO2后,既无沉淀也无气体产生的是
[ ]
①H2S水溶液 ②NaHCO3溶液 ③Na2SO3 ④Na2CO3溶液 ⑤溴水
A.②③ B.②③⑤ C.③⑤ D.⑤②
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| 光合作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
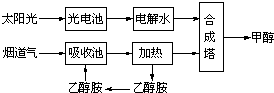
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读下列内容回答1-3小题:
2001年,专家从德国一家化肥厂生产出的硫酸铵中检出一种组成为N4H4(SO4)2的物质。经测定,该物质易溶于水,在水溶液中以SO42- 和N4H44+ 两种空间构型均为正四面体的离子存在。N4H44+ 离子极易被植物的根系吸收,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。已知SO42- 的结构式为 : 
(“→”表示共用电子对由S原子单方面提供),NH4+的结构式为 : ![]() 它们均是以S、N原子为中心的正四面体。回答问题(1)~(3):
它们均是以S、N原子为中心的正四面体。回答问题(1)~(3):
(1)N4的四个氮原子围成空间结型为 ( )
A.平面四边形 B.正六面体 C.正四面体 D.直线型
(2)预测N4H4+ 水溶液的PH ( )
A.可能>7 B.可能<7 C.可能=7 D.无法预测
(3)N4和N2分子的关系是( )
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
第题(分)将硼酸、发烟硫酸、萤石粉共热得到无色气体A,A为平面构型分子,密度约为空气的2.3倍,A用乙醚吸收后得到液态物质B。液态乙酸中存在微弱的自偶电离,离子电导率为139μS/cm,将B加入乙酸中形成均一透明的无色溶液,发现乙酸的离子电导率显著增强,达到1300-5800μS/cm,B与乙酸的混合溶液是具有良好应用前景的非水型电解质,与传统的水溶液电解质体系相比有独特的优势,扩大了电化学反应研究的物质范围和电位研究区间。试回答下列问题:
⑴ 写出A、B的结构简式 A _____________,B______________
⑵ 写出生成A的化学反应方程式____________________________________
⑶ 用方程式表示乙酸的自偶电离过程,并分析乙酸中加入B后,电导率显著提高的原因
⑷ 红外光谱显示,纯乙酸中存在两种羧羟基吸收峰,分析这两种峰产生的原因
⑸ 为什么说非水型电解质可以扩大电化学反应研究的物质范围和电位区间?
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)![]() 4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)![]() 2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。一定浓度的硫化钠溶液因向空气中释放臭味而称为“臭碱”,下列对这一现象的解释你认为最合理的是 (填序号)
A.硫化钠在水溶液中水解生成了NaOH和H2S气体
B.硫化钠溶液因吸收空气中的氧气被氧化生成了NaOH,同时生成有臭味的气体
C.硫化钠溶液水解的过程中因吸收空气中的CO2而放出H2S气体
(2)向同物质的量浓度BaCl2和KBr混合溶液中逐滴加入AgNO3溶液,先生成 沉淀,当![]() = 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且![]() 会 (填变大、变小、始终不变)。
会 (填变大、变小、始终不变)。
[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)![]() 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com