
阅读下列内容回答1-3小题:
2001年,专家从德国一家化肥厂生产出的硫酸铵中检出一种组成为N4H4(SO4)2的物质。经测定,该物质易溶于水,在水溶液中以SO42- 和N4H44+ 两种空间构型均为正四面体的离子存在。N4H44+ 离子极易被植物的根系吸收,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。已知SO42- 的结构式为 : 
(“→”表示共用电子对由S原子单方面提供),NH4+的结构式为 : ![]() 它们均是以S、N原子为中心的正四面体。回答问题(1)~(3):
它们均是以S、N原子为中心的正四面体。回答问题(1)~(3):
(1)N4的四个氮原子围成空间结型为 ( )
A.平面四边形 B.正六面体 C.正四面体 D.直线型
(2)预测N4H4+ 水溶液的PH ( )
A.可能>7 B.可能<7 C.可能=7 D.无法预测
(3)N4和N2分子的关系是( )
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
科目:高中化学 来源: 题型:阅读理解
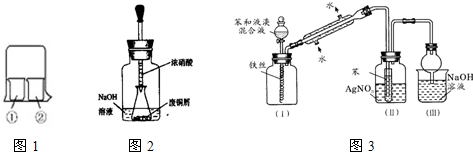
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
查看答案和解析>>
科目:高中化学 来源:重难点手册 高中化学·必修1 配人教版新课标 人教版新课标 题型:022
阅读下列内容,回答问题.

(1)图中所说的“碱”指的是________.
(2)用离子方程式表示丁中的化学反应原理:________.
(3)患胃溃疡病人不能服用含小苏打的药片来治疗胃酸过多,而是服用胃舒平[其中含Al(OH)3],其原因是________,相应的离子方程式为________.
(4)重金属离子对人体是有毒的.钡就是一种重金属,但硫酸钡(BaSO4)因其具有不溶于水、不溶于酸且不易被X光透过的性质,被用于“钡餐透视”时肠、胃等软组织的造影剂.碳酸钡可否用于“钡餐透视”的造影剂?________,为什么?________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
有一包由硝酸钾和不溶性杂质组成的固体混合物,投入一定量的水中,在保证无水分蒸发的前提下,改变温度,测得固体混合物的溶解情况如下:
表一 实验结果
温度/℃ | 10 | 40 | 75 |
剩余固体质量/g | 261 | 175 | 82 |
表二 硝酸钾在不同温度时的溶解度
温度/℃ | 10 | 40 | 50 | 60 | 65 | 80 |
溶解度/g | 20.9 | 63.9 | 85.5 | 110 | 126 | 169 |
通过计算回答(要有计算过程):
(1)实验过程中所用水的质量是 。
(2)对75 ℃所得溶液的下列说法正确的是 。
A.该溶液是饱和溶液 B.该溶液是不饱和溶液
C.82 g剩余固体中含有硝酸钾 D.82 g剩余固体中不含硝酸钾
(3)原固体混合物中含硝酸钾的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读下列实验内容,根据题目要求回答问题。
某学生测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100.00mL稀H2SO4溶液;取上述稀H2SO4 25.00 mL用0.14 mol·L-1的NaOH溶液滴定,消耗NaOH溶液15.00 mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
A用酸式滴定管取稀H2SO425.00 mL,注入锥形瓶中,加入2滴酚酞。
B、用待测定的溶液润洗酸式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)E→ C → D→_________→_________→_________→F;
②在G操作中如何确定终点?____________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“无影响”)_________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要仪器是(写一种)_________。
(4)如有1.00 mol/L和0.10 mol/L的NaOH溶液,应用 ____________的NaOH溶液,原因是____________。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________(选填“甲”或“乙”)中。(下图)
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值_________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度_________(计算结果到小数点后二位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com