
【题目】0.2mol 某烃 A 在氧气中完全燃烧后,生成CO2和H2O各1.2mol 。试回答:
(1)烃A的分子式为______________。
(2)若取一定量的该烃 A完全燃烧后,生成CO2和H2O各3mol ,则有______ g 烃 A参加了反应,燃烧时消耗标准状况下的氧气______ L 。
(3)若烃 A 不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃 A 的结构简式为______。
(4)若烃 A 能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有 4个甲基,烃A可能有的结构简式为(写一种即可)______________。
(5)比烃 A 少一个碳原子且能使溴水褪色的 A 的同系物有______种同分异构体(包括顺反异构)。
【答案】C6H12 42 100.8 ![]() (CH3)3CCH=CH2或(CH3)2CHC(CH3)=CH2或(CH3)2C=C(CH3)2 5
(CH3)3CCH=CH2或(CH3)2CHC(CH3)=CH2或(CH3)2C=C(CH3)2 5
【解析】
(1)根据原子守恒确定烃A分子中C、H原子数目,可知烃A分子式为C6H12;
(2)根据C原子守恒计算参加反应的烃A的物质的量,再根据m=n·M计算参加反应烃A的质量,根据物质反应前后质量守恒计算O2的物质的量,结合V=n·Vm计算消耗的氧气的体积;
(3)烃A不能使溴水褪色,不含不饱和键,在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,A为环己烷;
(4)烃A能使溴水褪色,含有1个C=C双键,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,故加成产物的结构简式为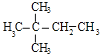 或
或![]() ,相邻C原子上各去掉1个H原子,还原碳碳双键;
,相邻C原子上各去掉1个H原子,还原碳碳双键;
(5)比烃A少一个碳原子且能使溴水褪色的A的同系物,分子式为C5H10,含有1个C=C双键。
(1)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol,根据原子守恒确定A分子中C原子数目为C:1.2mol÷0.2mol=6;含有的H原子数目为H:(1.2mol×2)÷0.2mol=12,所以该烃A分子式为C6H12;
(2)根据C原子守恒,可知参加反应的烃A的物质的量为n(C6H12)=3mol÷6=0.5mol,则参加反应烃A的质量为m(C6H12)=0.5mol×84g/mol=42g,烃C6H12燃烧的化学方程式为C6H12+9O2![]() 6CO2+6H2O,根据方程式可知1molC6H12完全燃烧消耗9molO2,则0.5molC6H12燃烧消耗4.5molO2,其在标准状况下的体积V(O2)=4.5mol×22.4L/mol=100.8L;
6CO2+6H2O,根据方程式可知1molC6H12完全燃烧消耗9molO2,则0.5molC6H12燃烧消耗4.5molO2,其在标准状况下的体积V(O2)=4.5mol×22.4L/mol=100.8L;
(3)烃A分子式为C6H12,烃A不能使溴水褪色,不含不饱和键,在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,A为环己烷,结构简式为![]() ;
;
(4)烃A能使溴水褪色,物质分子中含有1个碳碳双键,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,故加成产物的结构简式为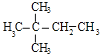 或
或![]() ,若加成产物为
,若加成产物为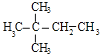 ,对应的A的结构为(CH3)3CCH=CH2;若加成产物为
,对应的A的结构为(CH3)3CCH=CH2;若加成产物为![]() ,则A可能为(CH3)2CHC(CH3)=CH2或(CH3)2C=C(CH3)2;
,则A可能为(CH3)2CHC(CH3)=CH2或(CH3)2C=C(CH3)2;
(5)比烃A少一个碳原子且能使溴水褪色的A的同系物,分子式为C5H10,含有1个碳碳双键,符合条件的同分异构体为:CH3CH2CH2CH=CH2、CH3CH2CH=CHCH3、CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2,共有5种不同结构。


科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。
![]()
(1)该小组同学欲用图所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
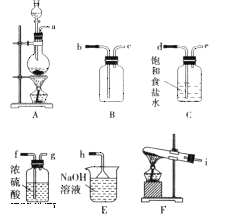
① 应该选择的仪器是__________(填字母)。
② 将各仪器按先后顺序连接起来,应该是a接__________,__________接__________,__________接__________,__________接h(用导管口处的字母表示)。
③ 浓盐酸与二氧化锰反应的离子方程式为__________。
(2)该小组同学设计分别利用图所示装置探究氯气的氧化性。
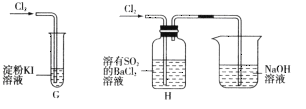
①G中的现象是__________,原因是__________(用化学方程式表示)。
②H中的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
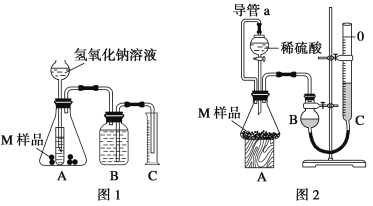
(1)写出实验1中可能发生反应的离子方程式:______________________________。
(2)实验1装置中小试管的作用是___________________________________________________。
(3)对于实验2,平视读数前应依次进行的两种操作是:①___________________②___________________。
(4)M样品中铜的质量的数学表达式为(用V1和V2 表示):__________________________。
(5)实验1进行实验前,B瓶中水没有装满,使测得气体体积____________ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2中导管a,使测得气体体积___________。
(6)该实验需要0.50 mol·L-1的NaOH溶液470 mL,请回答下列问题:
①配制时应称量______g NaOH,称量时需要托盘天平、______、______ (填仪器名称)。
②配制配制NaOH溶液时,将NaOH固体在烧杯中溶解,所得溶液立即转移至容量瓶中____(填“偏大”、“偏小”或“无影响”)。
③配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(7)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
请回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应③电子转移的方向和数目。KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
______________
(5)反应③中盐酸表现_________________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中,铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。工业流程如下:
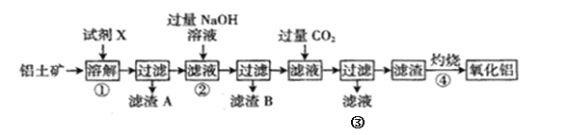
(1)试剂X应选择______(填标号)。
A.过量NaOH溶液 B.过量稀盐酸 C.过量FeCl3溶液
(2)若在实验室进行过滤操作,必须用到的玻璃仪器除了烧杯,还有_________;
(3)滤渣A和B的主要成份分别为_____、______;
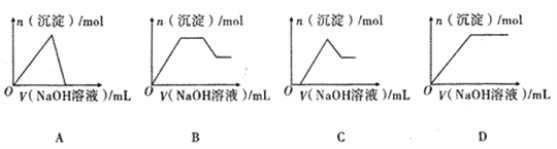
(4)若②中逐滴滴加NaOH溶液,则实验过程中产生沉淀的物质的量与加入NaOH溶液的体积之间的关系图正确的是_______;(填标号)
(5)③中与NaOH溶液反应的离子方程式为__________;
(6)④中发生反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为不符合安全要求的是![]()
![]()
A.做实验剩余的金属钠放回原试剂瓶中
B.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
C.金属钠着火时使用泡沫灭火器灭火
D.装氢氧化钠溶液的试剂瓶用橡胶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.1 mol O2中含有1.204×1024个氧原子,在标准状况下占有体积22.4L
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.同温、同压下,相同质量的气体都占有相同的体积
D.由0.2gH2和8.8gCO2、5.6gCO组成混合气体,其密度是相同状况下O2密度的0.913倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com