
【题目】T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%
【答案】C
【解析】A. 由表中数据可知,平衡时n(Cl2)=0.04mol,保持其他条件不变,升高温度,平衡时c(Cl2)=0.038mol/L,n(Cl2)=0.038mol/L×2L=0.076mol>0.04mol,可知升高温度时平衡正向移动,则正反应为吸热反应,△H>0,故A错误;B. 由表中数据可知前2s内,△n(Cl2)=0.03mol,则v(Cl2)=0.03mol÷2L÷2s=0.0075mol/(Ls),因不同物质表示的速率数值之比等于其化学计量数之比,则v(CO)=0.0075mol/(Ls),故B错误;C.根据表中数据可知,该反应在6s时达到平衡状态,则:
COCl2(g)![]() Cl2(g)+CO(g)
Cl2(g)+CO(g)
起始浓度(mol/L) 0.05 0 0
转化浓度(mol/L) 0.02 0.02 0.02
平衡浓度(mol/L) 0.03 0.02 0.02
所以平衡常数K=![]() =0.013,保持其他条件不变,起始时向容器中充入0.12molCOCl2和0.06molCl2、0.06molCO,则起始时COCl2的浓度为0.06mol/L、Cl2的浓度为0.03mol/L、CO的浓度为0.03mol/L,所以Qc=
=0.013,保持其他条件不变,起始时向容器中充入0.12molCOCl2和0.06molCl2、0.06molCO,则起始时COCl2的浓度为0.06mol/L、Cl2的浓度为0.03mol/L、CO的浓度为0.03mol/L,所以Qc=![]() =0.015>K=0.013,说明平衡向逆反应方向移动,反应达平衡前v(正)<v(逆),故C正确;D. 若与原平衡等效,则起始时向容器中充入0.10molCl2和0.10molCO,达到平衡时Cl2的转化率为:
=0.015>K=0.013,说明平衡向逆反应方向移动,反应达平衡前v(正)<v(逆),故C正确;D. 若与原平衡等效,则起始时向容器中充入0.10molCl2和0.10molCO,达到平衡时Cl2的转化率为: ![]() ×100%=60%,如果起始时向容器中充入0.10 mol Cl2和0.08 mol CO,相当于在原来的基础上减少0.02molCO,平衡将向正反应方向移动,Cl2的转化率减小,则Cl2的转化率小于60%,故D错误;答案选C。
×100%=60%,如果起始时向容器中充入0.10 mol Cl2和0.08 mol CO,相当于在原来的基础上减少0.02molCO,平衡将向正反应方向移动,Cl2的转化率减小,则Cl2的转化率小于60%,故D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一:FeO(s)+CO(g) ![]() Fe(s)+CO2(g)(正反应吸热),其平衡常数可表示为
Fe(s)+CO2(g)(正反应吸热),其平衡常数可表示为![]() , 已知1100℃,K=0.263
, 已知1100℃,K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值__________(“增大”“减小”或“不变”),平衡常数K值__________(“增大”“减小”或“不变”)。
(2)1100 ℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,在这种情况下,该反应是否处于平衡状态__________(填“是”或“否”),此时,化学反应速率v正__________v逆(填“大于”“小于”或“等于”),其原因是_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是 ( )

A. 2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与2 mol Ag具有的总能量
B. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu→Ag2O
D. 电池工作时,OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是人工合成的激素药物,能改善体内激素的平衡状态,其结构如图。下列有关叙述正确的是( )
![]()
A. 该有机物的分子式为C18H22O2
B. 该物质含有的官能团有醇羟基、碳碳双键
C. 该物质对称性好,所以没有顺反异构
D. 该有机物分子中,最多可能有18个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯水合法生产,反应的化学方程式如下:C2H4(g) + H2O(g) ![]() C2H5OH(g) ,下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4) : n(H2O) =1:1]。
C2H5OH(g) ,下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4) : n(H2O) =1:1]。

下列有关叙述正确的是
A. Y对应的乙醇的物质的量分数为![]()
B. X、Y、Z对应的反应速率:υ(X) >υ(Y) >υ(Z)
C. X、Y、Z对应的平衡常数数值:KX < KY <KZ
D. 增大压强、升高温度均可提高乙烯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示资源开发、回收、利用原理的反应方程式不正确的是( )
A. 海水提溴时用SO2吸收Br2蒸气:SO2+Br2+2H2O=2HBr+H2SO4
B. 将煤气化为可燃性气体:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
C. 用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3
D. 可以用铝和氧化铁制备铁单质:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲、乙两电解池,其中碳棒上有黄绿色气体产生。
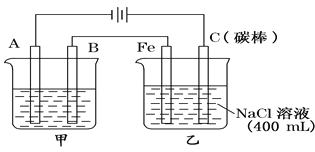
(1)甲池若为用电解原理精炼铜的装置,则:A是________极,电极反应为__________________,当一极有1mol纯铜析出时,另一极溶解的铜___________1mol(填“大于”、“小于”、“等于”)。
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe电极附近呈________色,电极反应式为_________。
(3)若甲池中电解质溶液为CuSO4溶液,电解过程中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为_______L,若此时乙池剩余液体为400 mL,则电解后溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液490mL。实验室提供以下仪器:①烧杯 ②100 mL量筒 ③药匙 ④玻璃棒 ⑤托盘天平(带砝码)。请回答下列问题:
(1)计算结果:需要称取NaOH固体的质量为____________;
(2)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是 _______________、______________。(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于________、后用于________;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是_______________;
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④加蒸馏水时不慎超过了刻度
(6)若实验过程中出现(5)中④这种情况你将如何处理?______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com