
����Ŀ���Ҵ�����Ҫ���л�����ԭ�ϣ�������ϩˮ�Ϸ���������Ӧ�Ļ�ѧ����ʽ���£�C2H4(g) + H2O(g) ![]() C2H5OH(g) ����ͼΪ��ϩ��ƽ��ת�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ[��ʼn(C2H4) : n(H2O) =1:1]��
C2H5OH(g) ����ͼΪ��ϩ��ƽ��ת�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ[��ʼn(C2H4) : n(H2O) =1:1]��

�����й�������ȷ����
A. Y��Ӧ���Ҵ������ʵ�������Ϊ![]()
B. X��Y��Z��Ӧ�ķ�Ӧ��������(X) >��(Y) >��(Z)
C. X��Y��Z��Ӧ��ƽ�ⳣ����ֵ��KX < KY <KZ
D. ����ѹǿ�������¶Ⱦ��������ϩ��ƽ��ת����
���𰸡�A
��������A. ��ͼ��֪��Y���Ӧ��ϩ��ƽ��ת����Ϊ20%����ʼn(C2H4) : n(H2O) =1:1����C2H4��H2O����ʼ���ʵ�����Ϊ1mol����������ʽ���У�
C2H4(g) + H2O(g) ![]() C2H5OH(g)
C2H5OH(g)
��ʼ��mol�� 1 1 0
ת����mol�� 0.2 0.2 0.2
ƽ����mol�� 0.8 0.8 0.2
��ƽ��ʱ�Ҵ������ʵ�������Ϊ�� ![]() =
=![]() ����A��ȷ��B. ��÷�Ӧ�����������С�Ŀ��淴Ӧ������ѹǿԽ����ϩ��ƽ��ת����Խ������ͼ��ɵã�P1��P2��P3����X��Y��Z�����Ӧ���¶�Խ��Խ�ߣ�����X��Y��Z��Ӧ�ķ�Ӧ��������(X) ����(Y) ����(Z)����B����C. ��ͼ��֪�������¶ȣ���ϩ��ƽ��ת���ʽ��ͣ�˵���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С����X��Y��Z��Ӧ��ƽ�ⳣ����ֵ��KX �� KY ��KZ����C����D. ��÷�Ӧ�����������С�Ŀ��淴Ӧ����ѹǿԽ����ϩ��ƽ��ת����Խ������÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ�����ϩ��ƽ��ת���ʽ��ͣ���D����ѡA��
����A��ȷ��B. ��÷�Ӧ�����������С�Ŀ��淴Ӧ������ѹǿԽ����ϩ��ƽ��ת����Խ������ͼ��ɵã�P1��P2��P3����X��Y��Z�����Ӧ���¶�Խ��Խ�ߣ�����X��Y��Z��Ӧ�ķ�Ӧ��������(X) ����(Y) ����(Z)����B����C. ��ͼ��֪�������¶ȣ���ϩ��ƽ��ת���ʽ��ͣ�˵���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С����X��Y��Z��Ӧ��ƽ�ⳣ����ֵ��KX �� KY ��KZ����C����D. ��÷�Ӧ�����������С�Ŀ��淴Ӧ����ѹǿԽ����ϩ��ƽ��ת����Խ������÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ�����ϩ��ƽ��ת���ʽ��ͣ���D����ѡA��


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.��״���£�1molˮ�������22.4LB.1mol�κ����壬�����Ϊ22.4L
C.1molO2�ڱ�״���µ����ԼΪ22.4LD.��״���£������Ħ�������22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ����ȡ�屽���ش��������⣺
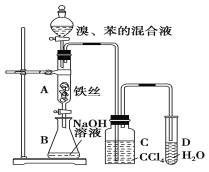
(1)д��A�з�Ӧ�Ļ�ѧ����ʽ��_______________________��
(2)C��ʢ��CCl4��������___________________________��
(3)D�м�����������Һ��ʵ�����Һ���ܿ�����ʵ������Ϊ_____________________��
(4)�����ڼ��𱽺ͼױ����Լ�Ϊ_________________��
(5)E���ʷ���ʽΪC8H10���ұ����ϵ�һ�ȴ���ֻ��һ�֣���E������Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������C2H6����Ϊһ������Դ�ڻ�ѧ����Ӧ�ù㷺����ش��������⣺(��ͼ��ʾ��װ����Ϊ����ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ����ʵ�������϶�ͭ��
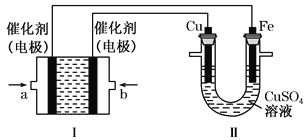
��a��Ӧͨ��______(����C2H6������O2��)��a���缫�Ϸ����ĵ缫��Ӧʽ��____________________________________��
����ƽ�����װ��������Һ��pH______(��д�����������С����������������ͬ)��װ������Cu2�������ʵ���Ũ��______��
����ƽ�����װ������Һ�е������ӳ���OH���������___________(����ˮ��)���ڴ˹���������ȫ��Ӧ��װ���������������仯12.8 g����װ��������������������________L(��״����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T Kʱ����2.0 L�����ܱ������г���0.10 mol COCl2��������ӦCOCl2(g)![]() Cl2(g)��CO(g)������һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±���
Cl2(g)��CO(g)������һ��ʱ���Ӧ�ﵽƽ�⡣��Ӧ�����в�õIJ������ݼ��±���
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
����˵����ȷ����( )
A. ���������������䣬�����¶ȣ�ƽ��ʱc(Cl2)��0.038 mol��L��1����Ӧ����H��0
B. ��Ӧ��ǰ2 s��ƽ������v(CO)��0.015 mol��L��1��s��1
C. ���������������䣬��ʼʱ�������г���0.12 mol COCl2��0.06 mol Cl2��0.06 mol CO����Ӧ�ﵽƽ��ǰ�����ʣ�v����v��
D. ���������������䣬��ʼʱ�������г���0.10 mol Cl2��0.08 mol CO���ﵽƽ��ʱ��Cl2��ת���ʴ���60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʰ��ᡢ��η���˳�����У���ȷ���ǣ� ��
A.���ᡢ���̼���
B.���ᡢ�ռʳ��
C.�����ᡢ���������
D.���ᡢ��ʯ�ҡ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC7H16��C5H11Cl��C5H10����״�������ǿռ乹�ͣ���ͬ���칹�����Ŀ�ֱ��У� ����
A. 9,8,5 B. 8,9,5 C. 9,9,6 D. 8,8,6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�����ܽ���������ԭΪ�Ȼ���
B.����������������л�ԭ��
C.�����������о���ȼ�գ�����ʲ�ɫ���а�������
D.Ϊ�ⶨ������ˮ��pH���ò�����պȡҺ�����pH��ֽ�ϣ������ɫ�����ռ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ˮ�к�����̬�ȣ�ͨ������ʵ��ⶨ��Ũ�ȡ�
��ȡˮ��10��0ml����ƿ�У�����10��0ml��KI��Һ(����)�������ķ�ӦΪ��Cl2+2KI��2KCl+I2������ָʾ��2~3�Ρ�
�ڢ�ȡһ�ζ�������������ˮ������ˮϴ��������0.01mol��L-1Na2S2O3��Һ��ϴ��Ȼ��װ��0.01mol��L-1Na2S2O3��Һ��0�̶����ϣ��ų��¶˼����ڵ����ݣ�����Һ����0�̶Ȼ�0�̶���ijһλ�ã����¶�����
�۽���ƿ���ڵζ����½��еζ��������ķ�ӦΪ��I2+2Na2S2O3=2NaI+ 2Na2S4O6 �Իش������ʴ�
��1������ټ����ָʾ����_______________________________��
��2�������Ӧʹ��________ʽ�ζ��ܡ�
��3���жϴﵽ�ζ��յ��ʵ��������___________________________________��
��4����0.1032mol/L HCl��Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ�����������ʵ������Ӱ�����____________
A.��ʽ�ζ���δ�ñ�������Һ��ϴ
B.��ƿδ�ô���Һ��ϴ
C.�ζ�ǰ�ζ��ܼ�������һ���ݣ��ζ���������ʧ��
D.�ζ�ʱ����Һ������ƿ��
��5��̼��H2CO3��K1=4.3��10-7��K2=5.6��10-11,����H2C2O4��K1=5.9��10-2��K2=6.4��10-50.1 mol/L Na2CO3��Һ��pH____________0.1 mol/L Na2C2O4��Һ��pH��(ѡ��������������С��������������)��������Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ�и�������Ũ�ȴ�С��˳����ȷ����_____________��(ѡ����)
A��c(H+)��c(HC2O4-)��c[HCO3-)��c[CO32-) B��c(HCO3-)��c(HC2O4-)��c(C2O42-)��c(CO32-)
C��c(H+)��c(HC2O4-)��c(C2O42-)��c(CO32-) D��c(H2CO3) ��c(HCO3-)��c(HC2O4-)��c(CO32-)
��6����֪�������ܵ���ʵ��ܶȻ�������Ksp��CaF2����1.5��10��10 ��25��ʱ��2.0��10��3mol��L-1�����ˮ��Һ�У�������ҺpH����������仯�����õ�c��HF����c��F-������ҺpH�ı仯��ϵ������ͼ��ʾ�������������Ϣ�ش��������⣺
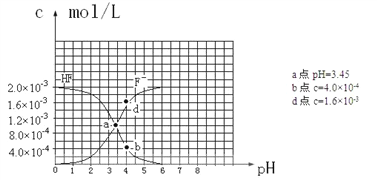
��25��ʱ��HF����ƽ�ⳣ������ֵKa��_______________________________��
��4.0��10��3 mol��L-1HF��Һ��4.0��10��4 mol��L-1 CaCl2��Һ�������ϣ����ڻ��ҺpHΪ4.0�����Ե��ڻ��Һ����ı仯����ͨ����ʽ����˵���Ƿ��г���������_______________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com