
【题目】利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)=CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应.测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。下列说法正确的是
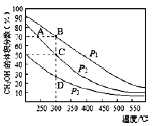
A.该反应的△H<O,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:v逆(状态A)>v逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,
达平衡时CH3OH的体积分数增大
【答案】B
【解析】
试题分析:A.升高温度,CH3OH的体积分数减小,平衡逆向移动,说明正反应为放热反应,△H<0,该反应为气体体积减小的反应,增大压强,平衡正向移动,可以提高CH3OH的体积分数,则p2<p1,A项错误;B.在C点,假设反应的CO的物质的量为x
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始120
反应x2xx
平衡1-x2-2xx
则x/[(1-x)+(2-2x)+x]×100%=50%,解得x=0.75,因此CO转化率为75%,B项正确;C.温度越高,反应速率越快,B的反应温度高,反应速率:ν逆(状态A)<ν逆(状态B),C项错误;D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,根据等效平衡的建立条件,达平衡时CH3OH的体积分数相同,D项错误;答案选B


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是
A. 常温下溶解度:Na2CO3<NaHCO3
B. 热稳定性:Na2CO3<NaHCO3
C. 与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D. 与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
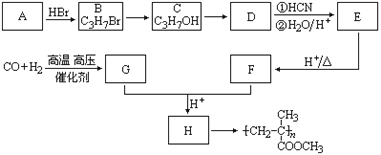
试写出:
(1)A、E的结构简式分别为:___________________、______________________。
(2)B→C、E→F的反应类型分别为:________________、________________。
(3)写出下列转化的化学方程式:C→D___________________________________________;G+F→H___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
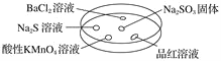
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镲、硒、硅等化学物质。
(1)基态铜原子有________种运动状态不同的电子,核外电子占据最高能层的符号是__________,占据该能层电子的电子云轮廓图形状为____________________;
(2)①硒、硅均能与氢元素形成气态氢化物。则它们形成的组成最简单的氢化物的分子构型分别为______________、_______________。
②若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为 Se___Si(填“>”或“<”)。
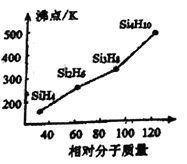
③人们把硅与氢元素形成的一类化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________________________________________。
③与铟、镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为________________,B与N之间形成_________键。
(4)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。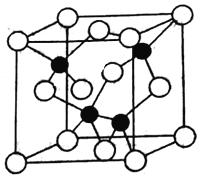
已知砷化镓的晶胞结构如图所示,则砷化镓的化学式为____________,AS和Ga之间的化学键为________和_________。砷化镓密度为ρg·cm-3, Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________(用含有ρ、NA等符号的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ________________ |
(2) | 乙炔 | ____________________ | _________________________ |
(3)D装置中氢氧化钠溶液的作用____________________________________。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):

甲的结构简式是___________________________________________________;反应(3)的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中以Zn、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬晶体,其装置如下图所示。仪器2中已预先加入锌粒,仪器3中已加人CH3COONa溶液。

资料卡:
①醋酸亚铬晶体[[Cr(CH3COO)2]22H2O;深红色晶体,不溶于冷水,是常用的氧气吸收剂。
②Cr2+不稳定,极易被氧气氧化,不与锌反应。
③部分相关的化学反应:
2CrCl3+Zn═2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O
④Ksp[Cr(OH)3]=6.3×10-31,![]() ≈4,lg2≈0.3
≈4,lg2≈0.3
回答下列问题:
(1)仪器1的名称是_______________。
(2)实验时先往仪器2中加盐酸,一段时间后再加CrCl3溶液,目的是_________。
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_______,打开阀门_______。
(4)本实验中锌粒要过量,其原因除了使产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是_______________。
(5)铬的离子会污染水资源。常温下要除去上述实验中多余的Cr2+,①先向废液中通入足量的______,将Cr2+转变为Cr3+,反应的离子方程式为_______;②再加入碱液,调节pH至少为_____才能使Cr3+沉淀完全[c(Cr3+)<10-5mol/L]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com