
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1 100 ℃时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应向 进行(填“左”或“右”),判断依据是 。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②反应达到平衡后,下列措施能使 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入H2 C.再充入CO2 D.将H2O(g)从体系中分离
E.充入He(g)
(1)①增大
②右 因为c(CO2)/c(CO)=0.25<0.263
(2)①0.225 mol/(L·min) ②B、D
【解析】(1)①因为炼铁反应为吸热反应,升高温度,平衡常数增大。
②FeO(s)+CO(g) CFe(s)+CO2(g)在1 100 ℃时的平衡常数为0.263,此时Qc=c(CO2)/c(CO)=0.025 mol·L-1/0.1 mol·L-1=0.25<0.263,说明反应没有达到平衡,反应向右进行。
CFe(s)+CO2(g)在1 100 ℃时的平衡常数为0.263,此时Qc=c(CO2)/c(CO)=0.025 mol·L-1/0.1 mol·L-1=0.25<0.263,说明反应没有达到平衡,反应向右进行。
(2)①根据反应过程中CO2的浓度变化可知,从反应开始到达平衡,CO2的浓度变化为0.75 mol·L-1,所以H2的浓度变化为3×0.75 mol·L-1=2.25 mol·L-1,H2的反应速率为2.25 mol·L-1/10 min=0.225 mol·L-1·min-1。
②使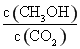 增大,需要使平衡向正反应方向移动,升高温度,平衡向逆反应方向移动,A错;再充入H2,CH3OH的浓度增大,CO2浓度减小,比值增大,B对;再充入CO2,CO2的转化率减小,CO2浓度增大,CH3OH浓度虽然增大,但是不如CO2浓度增大的多,比值减小,C错;将H2O(g)从体系中分离出来,平衡向右移动,CH3OH浓度增大,CO2浓度减小,比值增大,D对;充入He对平衡无影响,比值不变,E错
增大,需要使平衡向正反应方向移动,升高温度,平衡向逆反应方向移动,A错;再充入H2,CH3OH的浓度增大,CO2浓度减小,比值增大,B对;再充入CO2,CO2的转化率减小,CO2浓度增大,CH3OH浓度虽然增大,但是不如CO2浓度增大的多,比值减小,C错;将H2O(g)从体系中分离出来,平衡向右移动,CH3OH浓度增大,CO2浓度减小,比值增大,D对;充入He对平衡无影响,比值不变,E错


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源:2014年化学高考总复习课时演练 1-2物质的量在实验中的应用练习卷(解析版) 题型:填空题
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)≈_____mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是_____。

A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第四章非金属及其化合物练习卷(解析版) 题型:选择题
下列对于硝酸的认识中不正确的是( )
A.浓硝酸和稀硝酸都具有氧化性
B.铜与硝酸的反应属于置换反应
C.金属与HNO3反应一般不产生氢气
D.可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:选择题
下列有关化学实验的叙述正确的是( )
A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液
B.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
C.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下口放出
D.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:选择题
下列关于实验安全的叙述中错误的是( )
A.使用、制备有毒气体应在通风橱中进行,应有完全吸收处理装置
B.酒精及其他易燃物小面积失火,应该迅速使用湿抹布盖灭;钠、钾等失火应用泡沫灭火器扑灭
C.汞洒落后,应立即撒上硫粉,并打开墙下面的排气扇
D.学生实验时应戴防护眼镜,万一眼睛中溅进酸或碱溶液,应立即用水冲洗(切忌用手揉眼睛),然后请医生处理
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第六、七章化学反应与能量速率平衡卷(解析版) 题型:选择题
设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:

下列有关叙述正确的是( )
A.b>0B.在973K下增大压强,K2增大
C.a>bD.在常温下反应①一定能自发进行
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第六、七章化学反应与能量速率平衡卷(解析版) 题型:选择题
一定条件下,在体积为10 L的密闭容器中,2 mol X和2 mol Y 进行反应:2X(g)+Y(g) Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )
Z(g),经2 min达到平衡,生成0.6 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol·L-1·s-1
B.将容器体积变为20 L,Z的平衡浓度为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第八章水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性
B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强
C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O)
D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)= c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第二章化学物质及其变化练习卷(解析版) 题型:选择题
下列离子组在指定溶液中能大量共存的是( )
A.强酸溶液中:
B.滴加石蕊试液显红色的溶液中:
C.既能溶解Al(OH)3又能溶解H2SiO3的溶液中:
D.在含有大量 的溶液中
的溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com