
����Ŀ�����ΪԪ�����ڱ���һ���֣�
̼ | �� | Y | |
X | �� | Z |
�ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ ��
��2������Ԫ��ԭ�Ӱ뾶�����ǣ���Ԫ�ط��ţ� ��
��3��������ʵ��˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ���� �� a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ�
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4���е㣺H2YH2S���������=���������������� ��
��5��Y2��Y3��Ϊ���ͬλ�ء���ͬ���칹�塱��ͬ�������塱����
��6�����е���Y2��������ͼ��ʾװ�ã�ȼ�ϵ�أ�������������д��Y2�����Ե������Һ�з����ĵ缫��Ӧ����ʽ �� 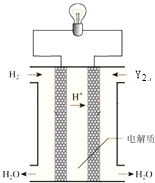
���𰸡�
��1���������ڡ��ڢ�A��
��2��Si
��3��ac
��4������H2O���Ӽ������������ȷ��Ӽ�������ǿ
��5��ͬ��������
��6��O2+4e��+4H+=2H2O
���������⣺��Ԫ�������ڱ���λ�ÿ�֪��XΪSi��YΪO��ZΪCl����1��ZΪCl��λ�����ڱ��е������ڡ��ڢ�A�壬���Դ��ǣ��������ڡ��ڢ�A�壻��2�����Ӳ�Խ�࣬ԭ�Ӱ뾶Խ��ͬ���ڴ�������ԭ�Ӱ뾶��С��������Ԫ����Si��ԭ�Ӱ뾶������Դ��ǣ�Si����3��a��Y������H2S��Һ��Ӧ����Һ����ǣ���Y�ĵõ���������ǿ��Y�ķǽ�����ǿ������aѡ�� b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ࣬�õ��Ӷ��ٲ��ܱȽϷǽ����ԣ���b��ѡ��
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸߣ���֪Y���⻯���ȶ�����Y�ķǽ�����ǿ����cѡ��
���Դ��ǣ�ac����4���е㣺H2Y��H2S��������H2O���Ӽ������������ȷ��Ӽ�������ǿ��
���Դ��ǣ�����H2O���Ӽ������������ȷ��Ӽ�������ǿ����5��Y2��Y3��Ϊͬ�������壬���Դ��ǣ�ͬ�������壻��6��O2�����Ե������Һ�еõ���������ˮ��������ԭ��Ӧ��������ӦΪO2+4e��+4H+=2H2O��
���Դ��ǣ�O2+4e��+4H+=2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ���ǣ� ��
A. ������ҺB. ������ҺC. �����ܽ�D. ����ͭ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A��K֮���������ͼ��ʾ��ת����ϵ������D��EΪ���ʣ���ش��������⣨ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������

��1��д���������������ʵ����ƣ�B�� __________��G��____________
��2����Ӧ��F��G���Ļ�ѧ����ʽ��_____________________________________________
��3����Ӧ��J��I�������ӷ���ʽ��_____________________________________________
��4����ҺI�л�����ҺJ����ȥJ�ķ����ǣ�________________________________________________________________
��5��������ҺI�������ӵķ����ǣ�__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������98%��Ũ����(�ѣ�1.84g��cm��3)���Ƴ�Ũ��Ϊ0.5mol��L��1��ϡ����480ml��
��ʵ�������У� A.10 mL��Ͳ B.20 mL��Ͳ C.������ƽ D.������
E.100 mL����ƿ F.250 mL����ƿ G.500 mL����ƿ H.��ͷ�ι� I.200 mL�ձ�
(1)����Ũ��������Ϊ______mL(������С�����һλ)��
(2)ʵ��ʱ��ѡ�õ�������D��I�� ______________________(�����)��
(3)�뽫���и�����������ȷ��������ں����ϣ����ظ�ʹ�ã���
A������Ͳ��ȡŨH2SO4��B�������ߵ�ҡ�ȣ�C���ý�ͷ�ιܼ�����ˮ���̶���
D��ϴ������������E��ϡ��ŨH2SO4��F������Һת������ƿ
�������ȷ��˳������Ϊ____________________________��
(4) ���ƹ����У����в�����ʹ���Ƶ�ϡ������ҺŨ��ƫ�ߵ���(�����)________��
����ȡŨ�������Ͳ������ˮϴ��2��3�Σ�����ϴ��Һת������ƿ
������ƿʹ��ʱδ����
�۶���ʱ���Ӷ���
�ܶ��ݺ���ҡ�ȡ����ã�����Һ����ڿ̶��ߣ��ټ�����ˮ�����̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����÷���˼�롢���ó���ʽ:A+H2O��B+C�ܽ�������ʵ�֪ʶ��
��1����A����:
�ٽ���������B����Ϊ���Բ�������Ԫ��A�����ڱ��е�λ��Ϊ_________��
��A��һ�ֻ���ɫ���嵥��������������������ʵĽṹʽΪ_________��
��B�ܸ�ʴ����������CΪ��������Ҫ�ɷ�֮һ��д���÷�Ӧ�Ļ�ѧ����ʽ: _________��
��2����A������:
��AΪ����ɫ��������A�ĵ���ʽΪ_________��
��A��C������ɹ⻯ѧ������������1molBת�Ƶĵ�����ĿΪ_________��
��3����B�׳ƾƾ���C��������ʳ�ô���Ҫ�ɷ������л���A��������_________��������AΪ��ʱ�����ܷ��������ˮ���������ܽ�ˮ��Ĺ��ɼ���Ũ�ȵĹ�ϵ��֪ʶ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ�� Kֵ��С���¶ȵĹ�ϵ�ǣ��¶����ߣ�Kֵ ������һ������һ����С�����������Ҳ���ܼ�С����
��2����һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO��g�� +H2O��g�� ![]() CO2��g�� +H2 ��g�� ��H<0��CO��H2OŨ�ȱ仯����ͼ����0��4min��ƽ����Ӧ����v��CO����mol��L-1��min-1��t��ʱ����Ũ����mol��L-1���ı仯��
CO2��g�� +H2 ��g�� ��H<0��CO��H2OŨ�ȱ仯����ͼ����0��4min��ƽ����Ӧ����v��CO����mol��L-1��min-1��t��ʱ����Ũ����mol��L-1���ı仯��
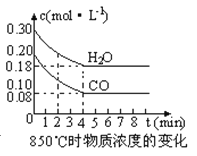
ʱ����min�� | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��3��t��������850����ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ϱ���
�ٱ���3min��4min֮�䷴Ӧ���� ״̬��c 1��ֵ 0.08 mol��L-1 ������ڡ�С�ڻ��������
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������ܵ�ԭ���� ����ѡ��������5min��6min֮����ֵ�����仯�����ܵ�ԭ���� ����ѡ����
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��A����״���µ��ܶ�Ϊ1.25g/L��B��D���������г������л��D�ܸ�̼�����Ʒ�Ӧ��E����ζ������֮���ת����ϵ��ͼ1��ʾ�� 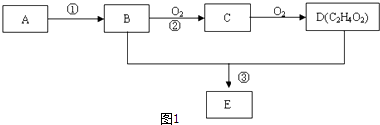
��1��A�ĵ���ʽΪ �� D�й����ŵ�����Ϊ ��
��2����AΪԭ�������ϳɸ߷��ӻ�����Ļ�ѧ����ʽΪ �� ��Ӧ������ ��
��3����Ӧ����Cu�������������½��У���ʵ��IJ����ǽ�������ͭ˿���ھƾ����ϼ��ȣ���ͭ˿��Ϊ��ɫʱ��Ѹ�ٽ�����뵽װ��B���Թ��У���ͼ2��ʾ�����۲쵽�������� �� �ظ�����2��3�Σ�д�����̢ڷ�Ӧ����ʽ �� 
��4��B��D��Ũ�����������ʵ�ַ�Ӧ�ۣ�ʵ��װ����ͼ3��ʾ�� 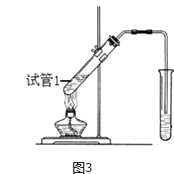
���Թ�1��ʵ�ַ�Ӧ�۵Ļ�ѧ����ʽΪ ��
�ڷ�Ӧ��ʼʱ�þƾ��ƶ��Թ�С����ȵ�ԭ���ǣ� �� ����֪���������ķе�Ϊ77�棻�Ҵ��ķе�Ϊ78.5�棻����ķе�Ϊ117.9�棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K+��NH4+��Fe2+��Al3+��Cl-��SO42-��CO32-��AlO2-�е����������ӡ�����Ũ�Ⱦ�Ϊ0.3mol��L-1��ijͬѧ����������ʵ�飺

����˵����ȷ����
A. ��ȷ��ԭ��Һ���Ƿ���Al3+��Cl-
B. ԭ��Һ�д��ڵ�����ΪNH4+��Fe2+��Cl-��SO42-
C. ��ҺX�д������ڵ���������NH4+��Fe2+��Ba2+
D. ��ȷ������C�ijɷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ��W��X��Y��Z��ԭ��������������W��ԭ�������������Ǵ�����������3����X��Y��Z������ͬ�����ڣ����ǵ�ԭ������֮����Wԭ��������5��������Ԫ��W��X��Y��Z��ɵ����п��ܵĶ���ֻ������У���Ԫ��W��Y�γɵĻ�����M���۵���ߣ���ش��������⣺
��1��WԪ��ԭ�ӵ�L������Ų�ʽΪ �� W3���ӵĿռ乹��Ϊ ��
��2��X������ˮ������Ҫ��Ӧ�Ļ�ѧ����ʽΪ ��
��3��������M�Ļ�ѧʽΪ �� �侧��ṹ��NaCl��ͬ�����۵����NaCl��M�۵�ϸߵ�ԭ���� �� ��һ�����Ļ�����ZX������M�Ͽ��Ƶ�ZX/M���������ڴ�̼����������¹��������ϳ�̼����¹�������̼������������У�̼ԭ�Ӳ��õ��ӻ���ʽ�� �� O��C��O�ļ���ԼΪ ��
��4��X��Y��Z���γ���������ṹ�Ļ�����侧����Xռ������������ģ�Yλ�ڶ��ǣ�Z��������λ�ã���þ�������ΪX��Y��Z= ��
��5������Ԫ��Z���ε���ɫ��ӦΪɫ����������ζ����Է�����ɫ��Ӧ����ԭ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com