
【题目】现有下列各组物质:
A.O2和O3 B.![]() 和
和![]() C.
C. ![]() D.
D. E.甲烷和庚烷
E.甲烷和庚烷
回答下列问题(填字母):
(1)____互为同位素。
(2)____互为同素异形体。
(3)____互为同系物。
(4)____互为同分异构体。
(5)____是同一种物质。
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,a= ____________。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。平衡时NH3的物质的量为____________。
(3)原混合气体与平衡时混合气体的总物质的量之比为 ____________。(写出最简整数比,下同)
(4)原混合气体中a∶b= ____________。
(5)达到平衡时,N2和H2的转化率之比为 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向氨水中不断通入CO2,随着CO2的增加,![]() 不断减小
不断减小
B. 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu
C. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H>0,△S<0
D. 将下图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。

请回答:
(1)形成单质A的原子的结构示意图为________。
(2)E的化学式为________。
(3)B与氢氧化钠反应生成D和H2O的化学方程式是________。
(4)在D的溶液中通入过量CO2气体的离子方程式________。
(5)下列说法正确的是______
A 水泥、玻璃、石英玻璃等都是传统硅酸盐材料。B 高纯度的硅单质广泛用于制作光导纤维。
C 化学分析中常用到的分子筛是硅酸盐材料。D 熔融烧碱不能选用陶瓷坩埚。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子机器设计和合成”有着巨大的研究潜力。人类步入分子器件时代后,使得光控、温控和电控分子的能力更强。如图是蒽醌套索醚电控开关。下列说法错误的是
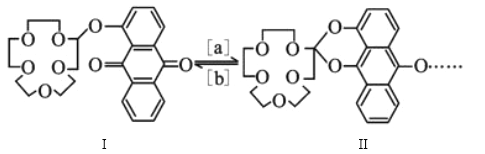
A. 物质Ⅰ的分子式是C24H28O8
B. 反应[a]是缩聚反应
C. 1mol物质Ⅰ可与8molH2发生加成反应
D. 物质Ⅰ不可能所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )

A.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B.Q的最高价氧化物的水化物的酸性比Z的强
C.X氢化物的稳定性比Q强
D.Y的原子半径比X的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(AgNO3溶液)、C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(水)、H(紫色石蕊试液)

(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其化学反应方程式是:________
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
下列装置中的现象是B________;D________请写出C中发生反应的化学方程式________
(3)在G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使H处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出G中的反应的化学方程式________。
(4)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是________。
(5)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作________;装置Ⅰ中的现象是________。
(6)若将E中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3 , 其物质的量比为1:2,则氧化剂和还原剂的物质的量之比为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,多釆用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2C![]() Na2S+2CO2↑。其主要流程如图如下:
Na2S+2CO2↑。其主要流程如图如下:

(1)上述流程中采用稀碱液比用热水更好,理由是_____________________。
(2)已知I2+2S2O32-═2I-+S4O62-所制Na2S·9H2O晶体中含有Na2SO4·5H2O等杂质为测定产品成分进行下列实验步骤如下:
a.取试样10.00g配成500.00mL溶液
b.取所配溶液25.00mL于碘量瓶中加入过量ZnCO3悬浊液除去Na2S后过滤向滤液中滴入2~3滴淀粉溶液用0.050 00mol·L-1I2溶液滴定至终点用去5.00mL I2溶液
c.再取所配溶液25.00mL于碘量瓶中加入50.00mL 0.050 00mol·L-1I2溶液并滴入2~3滴淀粉溶液振荡用标准Na2SO4溶液滴定多余I2用去15.00mL 0.100 0mol·L-1 Na2SO4溶液
①步骤b中用ZnCO3除去Na2S离子方程式为_________________。
②判断步骤c中滴定终点方法为________________________。
③计算试样中Na2S·9H2O和Na2SO4·5H2O质量分数(写出计算过程)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 萃取操作振荡时,要不时打开分液漏斗的活塞放气
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 蒸发时,蒸发皿必须要垫石棉网加热
D. 容量瓶、分液漏斗在使用前都要检查是否漏液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com