
【题目】如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(AgNO3溶液)、C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(水)、H(紫色石蕊试液)

(1)A是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其化学反应方程式是:________
(2)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
下列装置中的现象是B________;D________请写出C中发生反应的化学方程式________
(3)在G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,一种产物能使H处紫色石蕊试液变红,另一产物能使澄清石灰水变浑浊,写出G中的反应的化学方程式________。
(4)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是________。
(5)G处反应完毕后关闭分液漏斗旋塞,移去酒精灯,但由于余热的作用,A处仍有氯气产生,此时应该怎样操作________;装置Ⅰ中的现象是________。
(6)若将E中的水换成氢氧化钠溶液,溶液中不但有NaClO还有NaClO3 , 其物质的量比为1:2,则氧化剂和还原剂的物质的量之比为:________。
【答案】MnO2+4HCl ![]() MnCl2+2H2O+Cl2↑ 产生白色沉淀 溶液变蓝 2FeCl2+Cl2=2FeCl3 C+2H2O+Cl2
MnCl2+2H2O+Cl2↑ 产生白色沉淀 溶液变蓝 2FeCl2+Cl2=2FeCl3 C+2H2O+Cl2![]() CO2+4HCl 生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去 关闭Ⅰ处活塞 Ⅰ处b瓶内页面下降,c中液面上升 11:3
CO2+4HCl 生成的HCl使紫色石蕊试液变红色,剩余的氯气又与水作用生成次氯酸,又起漂白作用,使红色褪去 关闭Ⅰ处活塞 Ⅰ处b瓶内页面下降,c中液面上升 11:3
【解析】
(1)MnO2与浓盐酸反应生成MnCl2、H2O和Cl2;
(2)根据氯气的性质和氯水的成分确定实验现象;
(3)根据实验现象确定产物,进而得出反应的化学方程式;
(4)先变红是由于酸性气体产生,再变无色是由于漂白作用,据此分析;
(5)实验结束后,由于余热作用产生的氯气应进行收集或吸收;
(6)根据得失电子守恒进行计算。
(1)MnO2与浓盐酸反应生成MnCl2、H2O和Cl2 , 该反应的化学方程式为:MnO2+4HCl![]() MnCl2+2H2O+Cl2
MnCl2+2H2O+Cl2![]() ;
;
(2)氯气溶于水后产生HCl和HClO,其中Cl-能与Ag+结合成AgCl沉淀,故B中现象为产生白色沉淀;由于氯气具有氧化性,能将I-氧化成I2 , 淀粉遇碘变蓝色,故D中的现象为溶液变为蓝色;氯气具有氧化性,C中Fe2+具有还原性,二者可发生氧化还原反应,该反应的化学方程式为:2FeCl2+Cl2=2FeCl3;
(3)“ 一种产物能使H处紫色石蕊试液变红 ”则说明该产物的水溶液显酸性,结合元素守恒可知,产物为HCl;“ 另一产物能使澄清石灰水变浑浊 ”则该产物为CO2 , 故该反应的化学方程式为:C+2H2O+Cl2![]() CO2+4HCl;
CO2+4HCl;
(4)实验过程中生成的HCl使紫色石蕊试液变红色;剩余的氯气又与水作用生成HClO,具有漂白作用,使红色褪去;
(5)实验结束后,由于余热会继续产生氯气,此时应关闭Ⅰ中活塞,产生的氯气不通过后续装置,防止造成空气污染;此时可观察到Ⅰ中b瓶内液面下降,c中液面上升;
(6)该反应中氯气既是氧化剂又是还原剂。反应生成NaClO和NaClO3的物质的量之比为1:2,设其物质的量分别为1mol和2mol,则其失去的电子数为:1mol×1+2mol×5=11mol,故还原剂的物质的量为![]() ;根据得失电子守恒可得,反应过程中,氧化剂得到的电子数也为11mol,故氧化剂的物质的量为
;根据得失电子守恒可得,反应过程中,氧化剂得到的电子数也为11mol,故氧化剂的物质的量为![]() ;因此氧化剂和还原剂的物质的量之比为
;因此氧化剂和还原剂的物质的量之比为![]() 。
。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质性质比较中正确的是( )
A.稳定性:HCl>HBr>HIB.原子半径:C<N<O
C.还原性:Li>Na>KD.酸性:HClO4<HBrO4<HIO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况。t是到达平衡状态的时间。试回答:
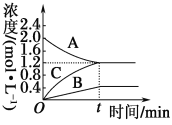
(1)该反应的反应物是________。
(2)该反应的化学反应方程式为_______________________________。
(3)若达到平衡状态的时间是2 min,A物质的平均反应速率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列各组物质:
A.O2和O3 B.![]() 和
和![]() C.
C. ![]() D.
D. E.甲烷和庚烷
E.甲烷和庚烷
回答下列问题(填字母):
(1)____互为同位素。
(2)____互为同素异形体。
(3)____互为同系物。
(4)____互为同分异构体。
(5)____是同一种物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钠固体在实验室保存中容易变质。现取一定量的久存氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系

(不考虑CO2在水中的溶解)。试计算:
(1)盐酸的物质的量浓度为________mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为________。
(3)若该氢氧化钠固体样品溶于水后用于吸收CO2,最多能吸收CO2的体积(标况下)是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
| ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ② | ③ | Ne | ||||||
3 | Na | ④ | ⑤ | ⑥ | |||||
(1)④的原子序数是________;
(2)⑤的原子结构示意图是____________;
(3)②和③两种元素的非金属性强弱关系是:②______③(填“>”、“<”或“=”);
(4)①和⑥两种元素组成的化合物中含有的化学键是____(填“共价”或“离子”)键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存且形成无色透明溶液的是
A.Mg2+、H+、C1-、OH-B.Na+、Ba2+、C1-、NO3-
C.Na+、H+、Cl-、CO32-D.K+、Cu2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:

(1)X中的非金属元素是_________。
(2)黑色化合物高温空气红棕色化合物的化学方程式是___________________。
(3)设计实验方案检验黄色溶液中的金属阳离子_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com