
����Ŀ����1��0.5 mol CO2������Ϊ__________�ˣ����к���CO2����__________�����ڱ�״���µ������________����
��2������£�1.92 gij��������Ϊ672 mL������������Է�������Ϊ__________��
��3��NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж���
��֪NaNO2�ܷ������·�Ӧ��2NaNO2��4HI��2NO����I2��2NaI��2H2O���÷�Ӧ����������_______�����ݸ÷�Ӧ������NaNO2��NaCl����ѡ�õ������У���ʳ�ס��ڵ⻯�ص�����ֽ���۵��ۡ��ܰƣ�����Ϊ����ѡ�õ�������_______________(�����)��
��4��Ϊ��ȥ Fe���л��е�����Al�ۣ�����ѡ�õ��Լ�Ϊ__________���ѧʽ�����䷴Ӧ�����ӷ���ʽ_________________��
��5��H2S��һ����ɫ���г�������ζ���ж��Ŀ�ȼ�����塣��30% FeCl3��Һ������Һ������H2S���壬�÷�Ӧ���ӷ���ʽΪ��__________________��
���𰸡� 22 0.5NA��3.01��1023 11.2 64 NaNO2 �٢� NaOH 2Al + 2OH- + 2H2O ===2AlO2- + 3H2�� 2Fe3+ + H2S �� S��+2Fe2+ + 2H+
����������1��0.5 molCO2������Ϊ��0.5mol��44g/mol=22g�����к���CO2����0.5mol��NA��/mol=0.5NA����0.5mol��6.02��1023=3.01��1023�����ڱ�״���µ������0.5mol��22.4L/mol=11.2L��
��2������£�672 mLij��������ʵ���Ϊ�� ![]() =0.03mol����������Ħ������Ϊ��
=0.03mol����������Ħ������Ϊ�� ![]() ������Է�������Ϊ64��
������Է�������Ϊ64��
��3����Ӧ2NaNO2��4HI��2NO����I2��2NaI��2H2O��NaNO2�ĵ�Ԫ�ػ��ϼ۽��ͣ�����NaNO2������������ˮ���۵��ۡ��ܰ���NaNO2������Ӧ����������������ѡ��KI��NaNO2��Ӧ����I2���������������²��ܷ�Ӧ��ʳ���������������ӣ��⻯����ʳ���е���������ӣ��������Ƶ���������������������ӷ�����Ӧ���ɵⵥ�ʣ�I2ʹʪ��ĵ��۵⻯����ֽ����������NaNO2��NaCl����ѡ��٢ڣ�
��4���������ܺ�����������Һ��Ӧ�����������ܣ��ʿ�ѡ������������Һ��ȥ Fe���л��е�����Al�ۣ��䷴Ӧ�����ӷ���ʽ�ǣ�2Al+2OH-+2H2O=2AlO2-+H2����
��5��FeCl3��Һ��H2S���巴Ӧ�������ʺ��Ȼ��������÷�Ӧ���ӷ���ʽΪ��2Fe3+ + H2S �� S��+2Fe2+ + 2H+��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Լ���ȥ���и������е��������ʣ���ȷ����
A���屽�е��壨���������������� B���������е��Ҵ���ˮ��
C�������е���ϩ������KMnO4��Һ�� D�����еļױ�����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������1��pH��ȵ�NaOH��Һ��CH3COONa��Һ���ֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH__________NaOH��Һ��pH����������������������������
��2�������ʵ���Ũ����ͬ�������백ˮ��Ϻ���Һ�е�c��NH4+����c��Cl-�������������� ��ˮ���������������������������������
��.ij�ռ���Ʒ�к����������������õĿ��������ʣ�Ϊ�˲ⶨ�ռ�Ĵ��ȣ��������µζ�������
A����250mL����ƿ�ж��ݳ�250![]() �ռ���Һ
�ռ���Һ
B������Һ����ȡ25mL�ռ���Һ����ƿ�в��μӼ��η�ָ̪ʾ��
C������ƽ��ȷ��ȡ�ռ���ƷW g�����ձ��м�����ˮ�ܽ�
D�������ʵ���Ũ��ΪM mol��L-1�ı�HCl��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶���Ϊ![]()
E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�������![]()
�ش��������⣺
��1����ȷ�IJ��������˳����������ĸ��д�� �� �� �� D ��
��2������ʽ�ζ���δ���������Һ��ϴ����Բⶨ����к�Ӱ�� ������ƫ��������ƫ����������Ӱ��������
��3�����ռ���Ʒ�Ĵ��ȼ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ�ȼ������ȵ���
A��C2H4��C3H6 B��1mol̼��3mol̼ C������������ D�����ۺ���ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ���������ֻ���������ӣ���Ԫ�أ� ��
A.һ���ǽ���Ԫ��
B.һ���ܺ�����������Һ��Ӧ��������
C.һ���Ǣ�A��Ԫ��
D.�����ǽ���Ԫ�أ�Ҳ���ܲ��ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.7g �Ȼ�粒�����������ʯ�һ�ϼ��ȣ�ʹ֮��ַ�Ӧ��
��1��д����Ӧ�Ļ�ѧ����ʽ��____________________��
��2�����ɵİ����ڱ�״���µ������______________L��
��3���ð�����һ��������ԭ�ɵ�������Ӧ�Ļ�ѧ����ʽΪ��__________���˷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����칤����м��ء��������뵨��ˮ�У�����ͭɫҲ�����ù������漰�ķ�Ӧ����Ϊ
A. �ֽⷴӦ B. ���Ϸ�Ӧ
C. ���ֽⷴӦ D. �û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��7H2O��������ԭ������ɫ������ҩ�ȣ��ڲ�ͬ�¶����ֽ�ø������������������������֪SO3��һ����ɫ���壬�۵�16.8�����е�44.8���������Լ���ˮ�Խ�Ũ����ǿ����Ư��ijЩ�л�Ⱦ�ϣ���Ʒ��ȡ��ش��������⣺
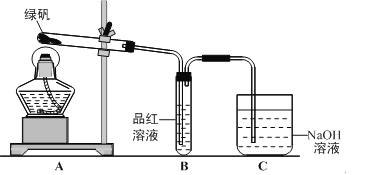
��1������ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ������̷��ķֽ���װ��B�пɹ۲쵽��������___________�������ɴ˵ó��̷��ķֽ�����к���SO2��װ��C��������__________________��
��2������ͬѧ��Ϊ����ͬѧ��ʵ����۲��Ͻ�����Ϊ��Ҫ����ʵ�顣�ҶԼ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ�����_____________��������ĸ��
A������SO2 B�����ܺ�SO2 C��һ������SO3
��3������ͬѧ�������Ϸ����̷����ȷֽ������O2�ų���Ϊ�ˣ�����ͬѧѡ�ü���ͬѧ�IJ���װ�ú���ͼ����װ����Ƴ���һ�����̷��ֽ���̬�����װ�ã�
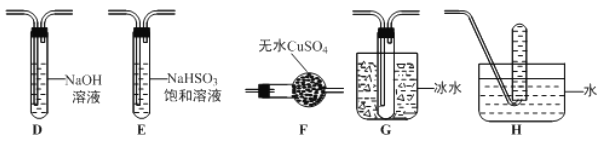
������ͬѧ��ʵ��װ���У��������ӵĺ���˳��Ϊ _______________��
����֤���̷��ֽ��������O2��ʵ�������������_______________��
��4��Ϊ֤���̷��ֽ�����к�����������ѡ�õ�ʵ���������Թܡ���ͷ�ιܡ�_______________ ��ѡ�õ��Լ�Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤�����淴ӦN2+3H2![]() 2NH3�Ѵﵽƽ��״̬������ ��
2NH3�Ѵﵽƽ��״̬������ ��
��һ��N��N������ͬʱ����6��N��H������
��v��N2��=0��2molL-1min-1��v��NH3��=0��4molL��1min-1
������������������ʱ����ϵѹǿ���ٸı䣻
�����º���ʱ�����������ܶȱ��ֲ��䣻
��NH3��N2��H2��������������ٸı䡣
A�� �٢ڢ� B�� �٢ۢ� C�� �ڢۢ� D���ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com