
【题目】下列离子方程式中正确的是()
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:![]()
B.小苏打与氢氧化钠溶液混合:![]()
C.NaHSO4溶液与Ba(OH)2溶液混合后呈中性:![]()
D.二氧化锰和浓盐酸共热:![]()
【答案】D
【解析】
离子方程式正误判断常用方法:检查反应物、生成物是否正确,即是否符合客观事实;检查各物质拆分是否正确,如难溶物、弱电解质等要保留化学式;检查是否遵循质量守恒和电荷守恒等。
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,正确的离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,A错误;
Fe(OH)3(胶体)+3H+,A错误;
B.小苏打与氢氧化钠溶液混合,反应生成碳酸钠和水,正确的离子方程式为:HCO3-+OH-=CO32-+H2O,B错误;
C.NaHSO4溶液与Ba(OH)2溶液混合后呈中性,溶液中的氢离子和氢氧根离子完全反应,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,C错误;
D.二氧化锰和浓盐酸共热生成氯化锰、氯气和水,该反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O, D正确。
Mn2++Cl2↑+2H2O, D正确。
答案选D。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(3)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)实验数据如表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两份30mL同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
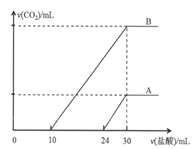
请回答下列问题:
(1)M溶液中溶质为(写化学式)___________,其物质的量之比是__________。
(2)N溶液溶质为(写化学式)____________,标准状况下CO2气体的体积为________,原NaOH溶液的物质的量浓度为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是()
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、陶瓷都是硅酸盐产品
③高纯度的硅单质广泛用于制作光导纤维
④普通玻璃是氧化物,成分可表示为SiO2
⑤粗硅制备单晶硅不涉及氧化还原反应
⑥硅酸铜钡( BaCuSiOx,铜为+2价),x等于6,可用氧化物形式表示为 BaO·CuO·2SiO2
A.①②⑥B.①②③C.①②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是

A. 图甲表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C. 图丙表示0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D. 图丁表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 molL-1 HClO溶液的pH = 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)
Ⅰ.实验步骤
(1)配制100mL待测白醋溶液:用______![]() 填仪器名称
填仪器名称![]() 量取10.00mL市售白醋,在烧杯中用水稀释后转移到______
量取10.00mL市售白醋,在烧杯中用水稀释后转移到______![]() 填仪器容量、名称
填仪器容量、名称![]() 中定容,摇匀即得待测白醋溶液.
中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂.
(3)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数:如果液面位置如图所示,则此时的读数为______mL.
![]()
(4)滴定:当________________________________________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) |
|
|
|
|
V(NaOH)(消耗) |
|
|
|
|
Ⅲ.数据处理与讨论
(5)甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积:V=![]() =15.24mL指出他的计算的不合理之处:_________________________________________________。
=15.24mL指出他的计算的不合理之处:_________________________________________________。
选取正确数据,可得![]() 市售白醋
市售白醋![]() ____mol/L;市售白醋总酸量
____mol/L;市售白醋总酸量![]() ____g/100mL。
____g/100mL。
(6)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________(填标号).
A.pHB.电离度C.电离常数D.溶解度
(7)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填标号).
A.碱式滴定管在用蒸馏水洗净后,未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com