
【题目】下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 molL-1 HClO溶液的pH = 5
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12,如图是向10mL AgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象。根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为1mol·L-1
B. 图中x点满足c(Ag+)·c(Cl-)= Ks p( AgCl)
C. 相同实验条件下,把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图象在终点x的纵坐标小于6
D. 相同实验条件下,若改为0.2mol·L-1 NaCl溶液时,x点的横坐标小于100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是()
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:![]()
B.小苏打与氢氧化钠溶液混合:![]()
C.NaHSO4溶液与Ba(OH)2溶液混合后呈中性:![]()
D.二氧化锰和浓盐酸共热:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________(用离子方程式表示)
(2)碳酸氢钠溶液蒸干并灼烧得到的固体物质是__________(填化学式)
(3)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_____________
(4)将AgCl分别放入①5mLH2O ②10mL0.2mol·L-1MgCl2溶液 ③20mL0.5mol·L-1NaCl溶液④40mL0.1mol·L-1HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是________________________(用序号填空)
(5)常温下amol/LCH3COOH稀溶液和bmol/LKOH稀溶液等体积混合:若c(K+)<c(CH3COO-),则a_____________b(填>、<、=),室温下,1mol/L相同体积的下列四种溶液:①KCl②FeCl3③HF④Na2CO3中,所含阳离子数由少到多的顺序是_________________________(用序号填空)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
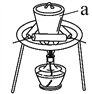
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
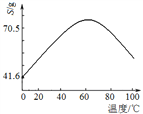
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它在爆炸时发生的化学反应为2KNO3+3C+S=A+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为__________。
②在生成物中,A的晶体类型为_______,含极性共价键的分子的中心原子轨道杂化类型为_____。
③已知CN-与N2互为等电子体,推算HCN分子中σ键与π键数目之比为_____。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
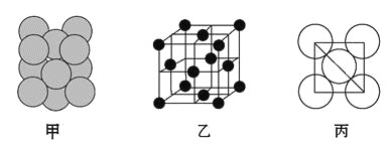
(3)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。则晶胞中该原子的配位数为________,该单质晶体中原子的堆积方式为四种基本堆积方式中的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:
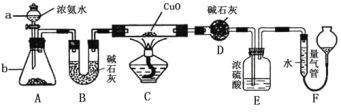
(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。设起始
CO(g)+3H2(g)。设起始![]() =Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是

A.该反应的焓变 △H>0
B.图中Z的大小为 a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com