
����Ŀ���й��Ŵ��Ĵ���֮һ�����ڻ�ҩ�����ڱ�ըʱ�����Ļ�ѧ��ӦΪ2KNO3+3C+S=A+N2��+3CO2��(����ƽ)
��1���ٳ�S�⣬����Ԫ�صĵ縺�ԴӴ�С����Ϊ__________��
�����������У�A�ľ�������Ϊ_______�������Թ��ۼ��ķ��ӵ�����ԭ�ӹ���ӻ�����Ϊ_____��
����֪CN-��N2��Ϊ�ȵ����壬����HCN������������������Ŀ֮��Ϊ_____��
��2��ԭ������С��36��Ԫ��Q��T�������ڱ��мȴ���ͬһ������λ��ͬһ�壬��ԭ������T��Q��2��T�Ļ�̬ԭ����Χ����(�۵���)�Ų�Ϊ______��Q2+��δ�ɶԵ�������_______��
��3����ij�������ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ�����и�ԭ�ӵ���λ��Ϊ________���õ��ʾ�����ԭ�ӵĶѻ���ʽΪ���ֻ����ѻ���ʽ�е�________��
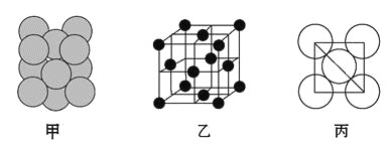
���𰸡�O>N>C>K ���Ӿ��� sp�ӻ� 1��1 3d84s2 4 12 �����������ܶѻ�
��������
��1���ٽ�����Խǿ�縺��ԽС���ǽ�����Խǿ���縺��Խ�ݴ˽��
����ԭ���غ�ȷ������AΪK2S�������Թ��ۼ��ķ���ΪCO2��������Cԭ���γ�2��C=O�������ӹ���Ϊֱ���ͣ������¶Ե��ӣ��ӻ����sp�ӻ���
�۸���CN-��N2�ṹ���ƣ�Cԭ����Nԭ��֮���γ��������з�����
��2��ԭ������С��36��Ԫ��Q��T�������ڱ��мȴ���ͬһ������λ��ͬһ�壬��Q��T���ڵڢ��壬��ԭ������T��Q��2����QΪFeԪ�أ�TΪNiԪ�أ��پ�����������Ų����ɽ��
��3���ɾ����ṹͼ��֪���Զ���ԭ��Ϊ�о�������֮�����ԭ�Ӵ��������ϣ�ÿ������ԭ��Ϊ12���湲�ã��ʾ����и�ԭ�ӵ���λ��Ϊ12���õ��ʾ�����ԭ�ӵĶѻ���ʽΪ�����������ܶѻ���
��1����ͬ����������ҵ縺����������Խǿ�縺��ԽС���ʵ縺��O��N��C��K��
�𰸣�O��N��C��K
����ԭ���غ��֪������AΪK2S���������ӻ�����ɼ������������ӹ��ɣ������Թ��ۼ��ķ���ΪCO2��������Cԭ���γ�2��C=O�������ӹ���Ϊֱ���ͣ������¶Ե��ӣ��ӻ������ĿΪ2��Ϊsp�ӻ���ʽ��
�𰸣����Ӿ��� sp�ӻ�
��CN-��N2�ṹ���ƣ�Cԭ����Nԭ��֮���γ���������HCN���ӽṹʽΪH-C��N�������к���1���Ҽ���2���м����������ڦҼ�����HCN�����ЦҼ���м���Ŀ֮��Ϊ1��1��
�𰸣�1��1
��2��ԭ������С��36��Ԫ��Q��T�������ڱ��мȴ���ͬһ������λ��ͬһ�壬��Q��T���ڵڢ��壬��ԭ������T��Q��2����QΪFeԪ�أ�TΪNiԪ�أ�NiԪ����28��Ԫ�أ�Niԭ�Ӽ۵����Ų�ʽΪ3d84s2��Fe2+�ĺ�������Ų�ʽΪ1s24s22p63s23d6��3d�ܼ���4�������ӣ�
�𰸣�3d84s2 4
��3���ɾ����ṹͼ��֪���Զ���ԭ��Ϊ�о�������֮�����ԭ�Ӵ��������ϣ�ÿ������ԭ��Ϊ12���湲�ã��ʾ����и�ԭ�ӵ���λ��Ϊ12���õ��ʾ�����ԭ�ӵĶѻ���ʽΪ�����������ܶѻ���
�𰸣�12 �����������ܶѻ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�

������Ͳ��ȡ50mL0.25mol��L��1���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50mL0.55mol��L��1NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��____________��
��2��д��ϡ�����ϡ����������Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ(�к�����ֵΪ57.3kJ��mol��1)___________��
��3������NaOH��Һ����ȷ������__________(������ѡ����ѡ��)��
A.�ز�������������B.��������������C.һ��Ѹ�ٵ���
��4��ʵ�����������
������д�±��еĿհף�
��ʼ�¶�t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ(t2��t1)/�� | |||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�ڽ�����Ϊ0.55mol��L��1NaOH��Һ��0.25mol��L��1������Һ���ܶȶ���1g��cm��3���кͺ�������Һ�ı�����c��4.18J��g��1������1�����к�����H��________(ȡС�����һλ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ����������ϵ���

A. ͼ�ױ�ʾ��ij��ѧƽ����ϵ�ı��¶Ⱥ�Ӧ������ʱ��ı仯
B. ͼ�ұ�ʾ��Ӧ��ϼ����յ���������������ɼ��ų�������
C. ͼ����ʾ0.1 mol��L��1NaOH��Һ�ζ�20 mL 0.1 mol��L��1����ʱ��ҺpH�ı仯
D. ͼ����ʾ��Ba(OH)2��Һ�еμ�ϡH2SO4����������Һ�ĵ����Ա仯���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����ʵ��������˵��������Ϊ������ʵ���
A. ���������Ư���� B. ����ʱ��������ˮ��Һ��pH < 7
C. ������ȶ����ֽ� D. 0.001 molL-1 HClO��Һ��pH = 5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС����������˽�������ݣ�
�Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ������ˮ�����ڶ�Ԫ��ǿ�ᣨΪ������ʣ���������ǿ��̼�ᣬ���۵�Ϊ101.5�棬��157��������Ϊ̽������IJ��ֻ�ѧ���ʣ�����������ʵ�飺
��1����ʢ��1mL����NaHCO3��Һ���Թ��м��������Ҷ�����Һ���۲쵽����ɫ���ݲ������÷�Ӧ�����ӷ���ʽΪ________��
��2����ʢ���Ҷ��ᱥ����Һ���Թ��е��뼸�������ữ��KMnO4��Һ������������Һ���Ϻ�ɫ��ȥ����˵���Ҷ������______��������������������ԭ������������������������ƽ�÷�Ӧ�����ӷ���ʽ��_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2��+_____H2O
��3����һ�������Ҷ�������Թ��У�����ͼ��ʾװ�ý���ʵ�飨�г�װ��δ�������

ʵ�鷢�֣�װ��C��G�г���ʯ��ˮ����ǣ�B��CuSO4��ĩ������F��CuO��ĩ��졣�ݴ˻ش�
������װ���У�D��������_________��
���Ҷ���ֽ�Ļ�ѧ����ʽΪ ________��
��4����С��ͬѧ��2.52g���ᾧ�壨H2C2O42H2O�����뵽100mL 0.2mol/L��NaOH��Һ�г�ַ�Ӧ����÷�Ӧ����Һ�����ԣ���ԭ����_______�������ּ�����������Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊ��_______�������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KClO3��Ũ������һ���¶��·������ɻ���ɫ���ױ���������ȣ��仯ѧ����ʽΪ��![]() ����ClO2����Ԫ�صĻ��ϼ�Ϊ+4�ۣ���
����ClO2����Ԫ�صĻ��ϼ�Ϊ+4�ۣ���
��1��Ũ�����ڷ�Ӧ�б��ֳ�����������____����д��ţ�
��ֻ�л�ԭ��
�ڻ�ԭ�Ժ�����
��ֻ��������
�������Ժ�����
��2��������0.1 mol Cl2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ___mol��
��3��ClO2���к�ǿ�������ԣ�����������������������Ч�ʣ���ͬ���������ʵõ�������������������C12��____����
��4����������з���ʽ�ĵ�����![]() ___
___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦA(g)��2B(g) ![]() 2C(g)����H>0������ͼ������ȷ����
2C(g)����H>0������ͼ������ȷ����
A. 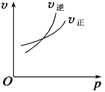 B.
B. 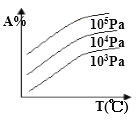 C.
C. 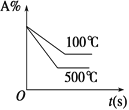 D.
D. 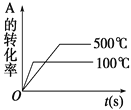
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ������к͵ζ����ⶨ���۰״�������(g/100mL)
��ʵ�鲽��
(1)����100mL����״���Һ����______![]() ����������
����������![]() ��ȡ10.00mL���۰״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�______
��ȡ10.00mL���۰״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�______![]() ����������������
����������������![]() �ж��ݣ�ҡ�ȼ��ô���״���Һ��
�ж��ݣ�ҡ�ȼ��ô���״���Һ��
(2)����ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2��_____��ָʾ����
(3)��ȡʢװ0.1000mol/LNaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ����:���Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ______mL��
![]()
(4)�ζ�����________________________________________ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Ρ�
��ʵ���¼
�ζ�����ʵ������(mL) | 1 | 2 | 3 | 4 |
V(��Ʒ) |
|
|
|
|
V(NaOH)(����) |
|
|
|
|
�����ݴ���������
(5)��ͬѧ�ڴ�������ʱ����ã�ƽ�����ĵ�NaOH��Һ�������V=![]() =15.24mLָ�����ļ���IJ�����֮����_________________________________________________��
=15.24mLָ�����ļ���IJ�����֮����_________________________________________________��
ѡȡ��ȷ���ݣ��ɵ�![]() ���۰״�
���۰״�![]() ____mol/L�����۰״�������
____mol/L�����۰״�������![]() ____g/100mL��
____g/100mL��
(6)��ͬѧ��ϸ�о��˸�Ʒ�ư״ı�ǩ���������л����б���������ΪʳƷ���Ӽ������������Ϸ���֤�����뱽�����Ʋ��ᷢ�����ӻ�����Ӧ���������һ���¶��µĴ����뱽�����________(����)��
A��pHB�������C�����볣��D���ܽ��
(7)�ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����______(����)��
A����ʽ�ζ�����������ˮϴ����δ�ñ�NaOH��Һ��ϴ
B����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
C����ƿ�м������״���Һ���ټ�����ˮ
D����ƿ�ڵζ�ʱ����ҡ����������Һ�彦����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij����С����ȡ��Ȳ���ⶨ��Ȳ��ijЩ���ʵ�ʵ�飮

��1��д��ʵ������ȡ��Ȳ�Ļ�ѧ����ʽ�� ______��
��2��ʵ������ȡ��Ȳʱ����Һ©���е�Һ�� aͨ���� ______��
��3��B��Һ�������� ______��
��4��װ��D�е������ǣ� ______��
��5����Ȳ�ܷ�ʹ��ĵ����Ȼ�̼��Һ��ɫ��______��������������������������д����ȫ��Ӧԭ��_______________
��6����ҵ�ϳ�����Ȳ���Ȼ����������ԭ�����ϳɾ�����ϩ����д����ط���ʽ _______________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com