
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置__________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置___________。
(2)从碘水中分离出I2,选择装置__________,该分离方法的名称为__________。
(3)装置A中①的名称是____________________,进水的方向是从_________口进水。装置B在分液时具体操作是_____________________________________________。
【答案】 D A B 萃取 直形冷凝管 下 将分液漏斗颈上的玻璃塞打开[或使塞上的凹槽(或小孔)对准漏斗上的小孔],打开活塞,使下层液体从漏斗管流下,当下层液体流尽时,立即关闭活塞,然后再从漏斗上口把上层液体倾倒出来
【解析】(1)蒸发能将易溶于水的固体和水的分离,从氯化钾溶液中得到氯化钾固体可用蒸发,因蒸馏可以实现水中难挥发性杂质和水的分离,则除去自来水中的Cl─等杂质,可用蒸馏,故选D;A;(2)碘微溶于水,碘易溶于苯、四氯化碳等有机溶剂,且苯、四氯化碳与水互不相溶,可用萃取法分离,故答B;萃取;(3)装置A中①的名称是直形冷凝管,使用时下口进水上口出水,装置B中在使用分液漏斗时,要打开分液漏斗上端活塞或使凹孔对准小孔,以保证内部液体顺利流下,故答案为:直形冷凝管;下;打开分液漏斗上端活塞或使凹孔对准小孔。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】[2015·上海]工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1∶2
C.每生成1 mol Na2S2O3,转移4 mol电子
D.相同条件下,每吸收10 m3 SO2就会放出2.5 m3 CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下RO3—与R—发生如下反应:RO3—+5R—+6 H+=3R2+3H2O,则下列关于R元素的说法中正确的是:( )
A. R位于元素周期表中的第VA族 B. R的氢化物的水溶液呈酸性
C. RO3—中的R元素只能被还原 D. R2在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料。利用CO2和 H2在催化剂的作用下合成甲醇,有关反应的反应热与平衡常数表示如下:
反应1:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1 K1
CO(g)+H2O(g) △H1 K1
反应2:CO(g)+2H2(g) ![]() CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
总反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3 K3
CH3OH(g)+H2O(g) △H3 K3
(1)①△H3=_________(用△H1、△H2表示)。
②K3 =____________(用K1、K2表示)。
③在恒温恒容的密闭容器中,能判断总反应达平衡状态的依据是______(填番号)。
a.容器中的压强保持不变
b.H2的质量分数保持不变
c.有两个C=O键断裂的同时水分子中有两个H-O键断裂
d.化学平衡常数K保持不变
e.c(CO2) =c(H2O)
f.速率v (CO2) =v(H2O)
④在某温度下,反应体系达平衡时,增大体系的压强,体系中,反应1的平衡______移动(填“向正反应方向”、“向逆反应方向”和“不”)。
(2)以上平衡常数随温度变化的曲线如图所示:
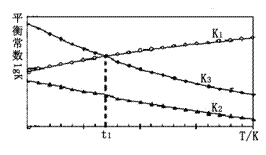
①则△H2_____△H3(填“大于”、“小于”或“等于”),理由是______________。
②温度为t1时,体系建立起化学平衡状态,测得c(H2)=0.1 mol·L-1 ,c(CH3OH):c(CO)=________。
(3)甲醇可用于制取氰化氢。已知:Ka(HCN) = 6.0×10-10,Kw=1×10-14氰化钠水解的离子方程式为CN-+H2O![]() HCN+OH-。
HCN+OH-。
①该水解反的平衡常数的值Kh=_________。
②一种由等物质的量浓度的NaCN和HCN组成的缓冲溶液,该溶液的pH____7 (“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
a.98%的浓硫酸 b.1%的品红溶液 c.1.0 mol·L-1的KI-淀粉溶液
d.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为_______mol·L-1(用含a、b、v1、v2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 硅是良好的半导体材料,且是制造光缆的主要材料
B. SiO2不溶于水,也不溶于任何酸
C. 观察K2SO4的焰色应透过蓝色的钴玻璃
D. Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中Fe也显+3价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com