
����Ŀ��ijͬѧ���÷���м(��Ҫ�ɷ�ΪFe2O3��Fe������̼)��ȡ̼��������FeCO3�����������ͼ���̣���������ͼ������˵������ȷ����
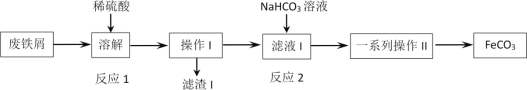
A.��ҵ����м������������֬����ͨ���ȱ���̼������Һϴ�ӳ�ȥ
B.��Ӧ2�����ӷ���ʽ��Fe2++HCO3-=FeCO3��+H+
C.����IΪ���ˣ�ϴ�Ӳ�����һϵ�в���IIΪ����Ũ������ȴ�ᾧ�����ˣ�ϴ��
D.Ϊ���������ܽ�ʱFe2+����������������мӦ�ʵ�����
���𰸡�BC
��������
����м(��Ҫ�ɷ�ΪFe2O3��Fe������̼)�м���ϡ���ᣬ������ӦFe2O3+3H2SO4=Fe2(SO4)3+3H2O��Fe2(SO4)3+Fe=3FeSO4��Fe+H2SO4=FeSO4+H2�������ˣ�������̼�˳�����Һ�м���NaHCO3��Һ��������ӦFe2++2HCO3- =FeCO3��+CO2��+H2O�����˺�ϴ�ӡ��������FeCO3��
A��ϴ�ӷ���м�������֬����ʹ���ȵı���̼������Һ��A��ȷ��
B�������Ϸ���֪����Ӧ2�����ӷ���ʽ��Fe2++2HCO3- =FeCO3��+CO2��+H2O��B����ȷ��
C����Ϊ����II�Ǵӻ�����з����FeCO3����������ӦΪ���ˡ�ϴ�ӡ�����Ȳ�����C����ȷ��
D��Fe2+���н�ǿ�Ļ�ԭ�ԣ�ϴ��ʱ�ױ������е��������������Է���мӦ�ʵ�������D��ȷ��
��ѡBC��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״�����Т�6.72L CH4����3.01��1023��HCl���ӣ���13.6g���⣬��0.2mol������NH3�������ж�����������Ĺ�ϵ�Ӵ�С��������ȷ���ǣ�������
A.����ڣ��ۣ��٣���B.�ܶȢڣ��ۣ��ܣ���
C.�����ڣ��ۣ��٣���D.��ԭ�����٣��ܣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�����������װ�ã���֤������̼���������Ʒ�Ӧʱ��Ҫ��ˮ�Ӵ���

(1)װ�����з�Ӧ�Ļ�ѧ��Ӧ����ʽ��__________________________��
(2)װ�����е��Լ���______������ţ���
a������Na2CO3��Һ b������NaHCO3��Һ c��ŨH2SO4
(3)װ�����е��Լ���______________��
����ʵ�飺
����1�����ɼ�K2���ر�K1����Һ©�������������ᣬ�������ǵ�ľ������a����
����2�����ɼ�K1���ر�K2����Һ©�������������ᣬ�������ǵ�ľ������a����
(4)����1�Ͳ���2�У�a�������ǵ�ľ��������ʵ������ֱ���__________��
(5)�������Ƹ�������̼��Ӧ�Ļ�ѧ����ʽ��__________________________��
ʵ�鷴˼��
(6)��ͬѧ������ɣ�������ʵ�鲻����֤����ˮ����ʱ�������Ƹ�������̼�����˻�ѧ��Ӧ������������__________________�����𰸺����͵÷֣��˿�3�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ3A(g)+B(g)�T2C(g)�����ֲ�ͬ�������½��з�Ӧ����ͬһʱ���ڣ���õķ�Ӧ�����ò�ͬ�����ʱ�ʾΪ����vA�T1mol/(Lmin)����vC�T0.5 mol/(Lmin)����vB�T0.5 mol/(Lmin)����������¸÷�Ӧ���ʴ�С�Ĺ�ϵ��ȷ����(����)
A. �ڣ��ۣ���B. �٣��ڣ���C. �ۣ��٣���D. �ڣ��٣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������С���Ҫ�����
(1)�����и������ʣ��������·���������϶�Ӧ����ĸ���ں�����
A.O2��O3 B.12C��13C C.�������D.CH3CH2CH2CH3��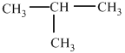 E.
E. 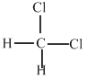 ��
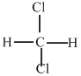
��
a.____________�������ʻ�Ϊͬλ�ء�
b.____________�������ʻ�Ϊͬ�������塣
c.____________������������ͬϵ�
d. ____________�������ʻ�Ϊͬ���칹�塣
(2)(1)��P4(s������)+5O2(g)=P4O10(s) ��H1=2983.2kJ/mol
��P(s������)+5/4O2(g)=1/4P4O10(s)����H=738.5kJ/mol
����������Ϣ��д������ת��Ϊ�����Ȼ�ѧ����ʽ________.
(3)��֪C2H4(g)��C2H5OH(l)��ȼ���ȷֱ���1141kJ/mol��1366.8kJ/mol��д��C2H4(g)��H2O(l)��Ӧ����C2H5OH(l)���Ȼ�ѧ����ʽ��_______��
(4)ij�о���ѧϰС����������ͷ�ͭм(��Cu��CuO)��Ϊԭ���Ʊ�����ͭ��ij��ʵ��ʹ���˷�ͭм��24g����һ��Ũ�ȵ�����100mL��ȫ�ܽ���Щ��ͭмʱ�����ռ�����״��������6.72L(����NO2��NO�������Ϊ2:1)����ͨ������ش��������⣺
�ٷ�ͭм��ͭ������ͭ�����ʵ���֮��___________��
�ڷ�Ӧ��õ�����Һ��H+��Ũ��Ϊ1.0mol/L����ԭ��������ʵ���Ũ�ȡ�(���跴Ӧǰ����Һ���������)_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¹���ѧ�ҹ���(F.Haber)��1902�꿪ʼ�о��ɵ���������ֱ�Ӻϳɰ����ϳɰ�Ϊ����������ʳ������������Ҫ���ס���ԭ��ΪN2(g)+3H2(g)2NH3(g) ��H=-92.4kJ/mol
(1)����֪H-H���ļ���Ϊ436.0kJ/mol��N-H�ļ���Ϊ390.8kJ/mol����N![]() N�ļ���ԼΪ_____kJ/mol
N�ļ���ԼΪ_____kJ/mol
(2)�ϳɰ���Ӧ���Ӵ������ѷ�������������ý���������˷�Ӧ�����˻�ܡ�������ԭ����ͼ��ʾ������˴�����������Ӧ��������______����(������һ����Ӧ���������ڶ�����Ӧ��)��δʹ�ô���ʱ�淴Ӧ���______����Ӧ���(������������С����������������)
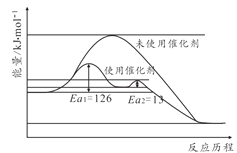
(3)��ƽ������ʽǶȿ��ǣ���ҵ������ȡ20MPa��50MPa�ĸ�ѹ�ϳɰ�ԭ��______
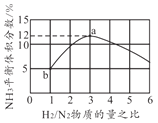
(4)һ���¶��º��������У��Բ�ͬ��H2��N2���ʵ���֮�ȼ��룬ƽ��ʱNH3���������ͼ��ʾ����H2ת����a��______b��(��"��������С����������������)������ʼѹǿΪ20MPa����b��ʱ��ϵ����ѹǿԼΪ______MPa��
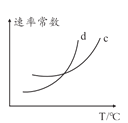
(5)���÷�Ӧ�����淴Ӧ���ʷֱ��ʾΪv��=K��![]() ��v��=K��c2(NH3)����һ���¶��£��÷�Ӧ ��ƽ�ⳣ��K=______(�ú�K����K���ı���ʽ��ʾ)����K����K�������¶ȵĺ����������¶����߶����ߣ���ͼ��c��d�ֱ��ʾ______��______���¶ȱ仯����(��K������K��)��
��v��=K��c2(NH3)����һ���¶��£��÷�Ӧ ��ƽ�ⳣ��K=______(�ú�K����K���ı���ʽ��ʾ)����K����K�������¶ȵĺ����������¶����߶����ߣ���ͼ��c��d�ֱ��ʾ______��______���¶ȱ仯����(��K������K��)��
(6)�����£���20mL��0.1mol/L��������ͨ��һ����������Ӧ����Һ������(������Һ����仯���Բ���)��������Һ��c(NH4+)=_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ������ͬϵ����ǣ� ��
��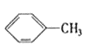 ��
��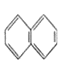 ��
��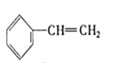 ��C2H4 ��CH2=CH-CH=CH2��C3H6��
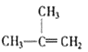
��C2H4 ��CH2=CH-CH=CH2��C3H6��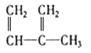 ��
��
A. �ܺ͢�B. �ٺ͢�C. �ݡ��ߺ͢�D. �ܡ��͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij���Ľṹ��ʽΪ
![]()
��1������������Ϊ_______________��
��2������������ϩ������һ��̼̼˫�����������ӳɶ�������ϩ���Ľṹ��_____�֣�����������ijȲ������һ��̼̼�����������������ӳɶ�������Ȳ���Ľṹ��ʽΪ_______________��
II����״���£�1.68 L��ɫ��ζ�Ŀ�ȼ��������������������ȫȼ�գ���������ͨ����������ʯ��ˮ���õ��İ�ɫ��������Ϊ15.0 g������������ʯ������ȼ�ղ������9.3 g��
��1������ȼ�ղ�����ˮ������Ϊ_________��
��2����ԭ�����ǵ�һ���������壬ͨ�������ƶ����ķ���ʽ��_____________��
��3����ԭ���������ֵ����ʵ�������̬���Ļ�����д�����ǵĽṹ��ʽ(Ҫ��д��һ��������������ʵĽṹ��ʽ����)��__________________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiCl4�����Ѿ�����Ҫ�ɷ�ΪTiO2���Ʊ��ѣ�Ti������Ҫ�м����Ʊ���TiCl4������ʾ��ͼ���£�
![]()
���ϣ�TiCl4�����������Ȼ��������
������ | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
�е�/�� | 58 | 136 | 181�������� | 316 | 1412 |
�۵�/�� | 69 | 25 | 193 | 304 | 714 |
��TiCl4�е��ܽ��� | ���� | ���� | �� | ���� | |
��1���Ȼ����̣�TiO2��Cl2����ֱ�ӷ�Ӧ����̼����CO��CO2��ʹ��Ӧ���Խ��С�
��֪��TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ��H1=+175.4 kJ��mol-1
2C(s)+O2(g)=2CO(g) ��H2=-220.9 kJ��mol-1
�� ����¯�м�̼�Ȼ�����TiCl4(g)��CO(g)���Ȼ�ѧ����ʽ��____________________��
�� �Ȼ�������CO��CO2�����ת����������ͼ�жϣ�CO2����CO��Ӧ�Ħ�H_____0���������������=�������ж����ݣ�_______________��
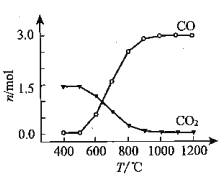
�� �Ȼ���Ӧ��β���봦�����ŷţ�β���е�HCl��Cl2�����տɵô����ᡢFeCl3��Һ����β��������Һ������__________________________��
�� �Ȼ�������ȴ�����£������˵õ���TiCl4���Һ���������к���_____________��
��2�����ƹ��̣���TiCl4����������ô�TiCl4��ʾ��ͼ���£�
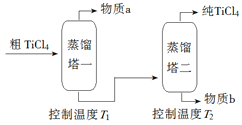
����a��______________��T2Ӧ������_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com