
【题目】在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③13.6g硫化氢,④0.2mol氨气(NH3)。下列对这四种气体的关系从大到小描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>①>④D.氢原子数①>④>③>②
【答案】D
【解析】
①6.72LCH4的物质的量为0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,
③13.6g硫化氢的物质的量为![]() =0.4mol,④0.2mol氨气(NH3),则
=0.4mol,④0.2mol氨气(NH3),则
A. 同温同压下,体积之比等于物质的量之比,所以体积②>③>①>④,A项正确;
B. ①CH4相对分子质量为16,②HCl相对分子质量为36.5③硫化氢相对分子质量为34,④氨气相对分子质量为17,同温同压下,密度之比等于相对分子质量之比,所以密度②>③>④>①,B项正确;
C. ①6.72L CH4的质量为0.3mol×16g/mol=4.8g,②3.01×1023个HCl分子的质量为0.5mol×36.5g/mol=18.25g,③13.6g硫化氢,④0.2mol氨气(NH3)的质量为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,C项正确;
D. 氢原子物质的量分别为:①0.3mol×4=1.2mol,②0.5mol,③0.4mol×2=0.8mol,④0.2mol×3=0.6mol,所以氢原子数①>③>④>②,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】Cl2是中学化学重要气体之一,实验室常用二氧化锰与浓盐酸反应制取Cl2。请回答下列问题:
Ⅰ实验室用二氧化锰制取Cl2的化学方程式为______________________________,如图所示制取氯气装置中至少存在_____________明显错误。
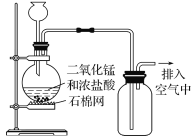
Ⅱ实验室也可用高锰酸钾与浓盐酸反应制取Cl2,并收集和检验Cl2的性质。
已知:①KMnO4在不加热的条件下可与浓盐酸发生反应制取Cl2。
②无水CaCl2可吸收水蒸气。
(1)将反应原理补充完整:2KMnO4+16HCl(浓)=________+5Cl2↑+8H2O。
(2)选择实验装置,完成相应的实验:
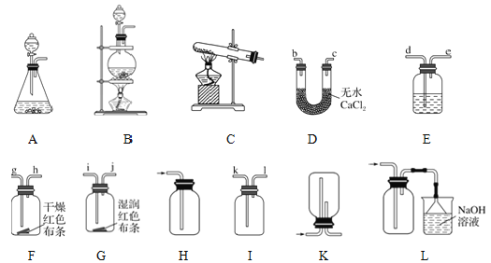
①若制取、收集干燥纯净的Cl2,按装置连接顺序可以选择其中的______(填序号)进行实验。
②若按A-E-D-F-G-L顺序连接装置进行实验,可得出的实验结论是___________。
③在上述实验①和②中,制取氯气前必须进行的一项操作是______,装置E中的试剂是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
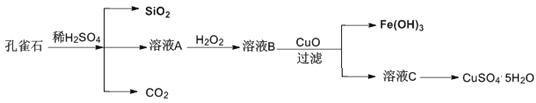
请回答下列问题:
(1)溶液A的金属离子有Fe3+和______________。
(2)溶液A中加入H2O2的目的是______________,发生的离子方程式为_____________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、______________、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
请根据表中信息回答下列问题
(1)元素T在周期表中位于第_____周期第_____族
(2)元素T与X相比,原子半径较大的是 ________(用元素符号表示);
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为_________该化合物与水反应方程式:_____________________
(4)元素Y与元素Z相比,金属性较强的是________(用元素符号表示);
下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
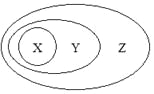
X | Y | Z | |
A | CuSO4·5H2O | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | 碱性氧化物 | 氧化物 | 化合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0molL﹣1稀硫酸,
(1)需量取浓硫酸的体积为_____mL。
(2)配制溶液时,一般可以分为以下几个步骤:①量取 ②计算 ③溶解 ④颠倒摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为________________,本实验必须用到的仪器有量筒、玻璃棒、烧杯、胶头滴管、还有___________。
(3)在配制过程中,下列操作会引起浓度偏高的是____,无影响的是____(填序号)。
①没有洗涤烧杯和玻璃棒;
②转移溶液时不慎有少量洒到容量瓶外面;
③容量瓶不干燥,含有少量蒸馏水;
④定容时俯视刻度线;
⑤未冷却到室温就将溶液转移到容量瓶并定容;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水反应生成一种氯化 物和两种氮化物,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

①仪器M的名称为_____.
②制备NO发生装置可以选用____(填写字母代号),请写出发生反应的离子方程式: ________.
③欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a->______(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOC1,装置如下图所示。操作为:检验装置气密性并装入药品,打开K2,然后再打开K3通入一段时间气体Cl2,然后进行其他操作,当Z有一定量液体生成时, 停止实验。
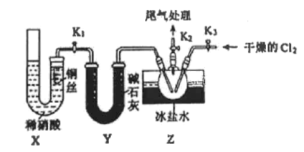
①实验室也可用X装置制备NO,相对甲组同学的气体发生装置,X装置的优点为______.
②若无装置Y,则Z中NOC1可能发生反应的化学方程式为____.
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用 cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是________;亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)= 1.56×10-10, Ksp(Ag2CrO4)=l×l012]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
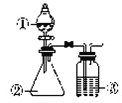
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6 mol A气体和5 mol B气体混合充入4 L 密闭容器中,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
A. x=2B. B的转化率为20%
C. 平衡时A的浓度为0.75 mol·L-1D. 恒温达到平衡时容器内的压强为开始的75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com