
����Ŀ����98%��Ũ����(���ܶ�Ϊ1.84g/cm3)����100mL 1.0molL��1ϡ���ᣬ
(1)����ȡŨ��������Ϊ_____mL��
(2)������Һʱ��һ����Է�Ϊ���¼������裺����ȡ �ڼ��� ���ܽ� �ܵߵ�ҡ�� ��ת�� ��ϴ�� �߶��� ����ȴ������ȷ�IJ���˳��Ϊ________________����ʵ������õ�����������Ͳ�����������ձ�����ͷ�ιܡ�����___________��
(3)�����ƹ����У����в���������Ũ��ƫ�ߵ���____����Ӱ�����____(�����)��
��û��ϴ���ձ��Ͳ�������
��ת����Һʱ������������������ƿ���棻
������ƿ�����������������ˮ��
�ܶ���ʱ���ӿ̶��ߣ�
��δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ�����ݣ�
���ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߡ�
���𰸡�5.4mL �ڢ٢ۢ�ݢޢߢ� 100mL����ƿ �ܢ� ��
��������
��1������c=![]() �����Ũ�����Ũ�ȣ�����ϡ��ǰ�����ʵ������䣬�������ҪŨ����������
�����Ũ�����Ũ�ȣ�����ϡ��ǰ�����ʵ������䣬�������ҪŨ����������
��2������һ�����ʵ���Ũ�ȵ���Һ�����ƹ��̼�����Ҫ���������в����������������ȷ����
��3������c=![]() ������������
������������
��1��![]() ��ϡ��ǰ�����ʵ������䣬
��ϡ��ǰ�����ʵ������䣬
![]() ��
��![]() ��
��![]() ��
��![]() ��
��
��2��������Һʱ�IJ��������㡢��ȡ���ܽ⡢��ȴ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȣ�����ȷ����˳��Ϊ���ڢ٢ۢ�ݢޢߢܣ���ʵ���и�������������Ͳ�����������ձ�����ͷ�ι��⣬����Ҫ100mL����ƿ��
��3����û��ϴ���ձ��Ͳ����������ʵ����ʵ�����ƫС�����ʵ���Ũ��ƫ�ͣ�
��ת����Һʱ������������������ƿ���棬���ʵ����ʵ�����ƫС�����ʵ���Ũ��ƫ�ͣ�
������ƿ�����������������ˮ�������ʵ����ʵ������䣬��Һ��������䣬���ʵ���Ũ�Ȳ��䣬����Ӱ�죻
�ܶ���ʱ���ӿ̶��ߣ���Һ���ƫС�����ʵ���Ũ��ƫ�ߣ�
��δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ�����ݣ���ȴ��Һ���½�����Һ���ƫС�����ʵ���Ũ��ƫ�ߣ�
���ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߣ���Һ���ƫ�ߣ����ʵ���Ũ��ƫ�͡�
��Ũ��ƫ�ߵ��ǣ��ܢݣ���Ӱ����ǣ��ۡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊȷ��ijNH4NO3��(NH4)2SO4��������ɣ���ȡ4����Ʒ�ֱ����50.0mL��ͬŨ�ȵ�NaOH��Һ�У����ȳ�ַ�Ӧ(���Ⱥ���ȫ���ݳ�)������Ļ����������Ͳ������������(��״��)�Ĺ�ϵ���±���
ʵ����� | �� | �� | �� | �� |
NaOH��Һ���(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
��Ʒ����(g) | 3.44 | m | 17.2 | 21.5 |
NH3���(L) | 1.12 | 2.24 | 5.60 | 5.60 |
�Լ��㣺
(1)m��________g��c(NaOH)��___________ mol��L��1
(2)��Ʒ��NH4NO3��(NH4)2SO4���ʵ���֮��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����о�DZˮͧ�й�����ϵ��Ӧ������װ��ͼ(�г�������)��
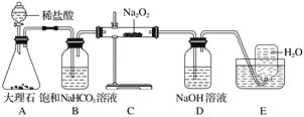
��1��Aװ��ΪCO2�ķ���װ�ã���Ӧ�����ӷ���ʽΪ____________________��
��2��Bװ�ÿɳ�ȥAװ���п��ܻӷ�����___________����Ӧ�����ӷ���ʽΪ_______________��
��3��Cװ��ΪO2�ķ���װ�ã���Ӧ�Ļ�ѧ����ʽΪ__________________��________________��
��4��Dװ�ÿɳ�ȥCװ����δ��Ӧ��__________����Ӧ�����ӷ���ʽΪ____________________��
��5��Eװ��Ϊ��ˮ���ռ�O2��װ�ã��������ռ�������ΪO2�ķ���Ϊ_____________________��
��6��Cװ���й����ɵ���ɫ��ȫ��Ϊ��ɫ���������ɷֵ�ʵ�鷽��Ϊȡ����Cװ���з�Ӧ��Ĺ�������ˮ������Һ�е������___��Һ�����а�ɫ�������ɣ���֤�������к���___�����ˣ�����Һ�е��뼸�η�̪��Һ����__�Ҳ���ɫ����֤�������к���__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���dz�����Ҫ��Ⱦ֮һ��������һ�ְ취����������������װ��ת��������ʹһ��������һ����̼��Ӧ���ɿɲ��������̬ѭ���������壬����ʹ������ȼ�ռ����������ת��������˵���������
A. һ��������һ����̼��Ӧ�Ļ�ѧ����ʽΪ2CO��2NO![]() 2CO2��N2
2CO2��N2
B. �˷�����ȱ�������ڶ�����̼�����࣬������߿��������
C. Ϊ���ٳ�����ȾӦ��������Դ
D. ����β����������������Ѫ�쵰��϶�ʹ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״�����Т�6.72L CH4����3.01��1023��HCl���ӣ���13.6g���⣬��0.2mol������NH3�������ж�����������Ĺ�ϵ�Ӵ�С��������ȷ���ǣ�������
A.����ڣ��ۣ��٣���B.�ܶȢڣ��ۣ��ܣ���
C.�����ڣ��ۣ��٣���D.��ԭ�����٣��ܣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�������Ͻ���Ʒ����Ϊ���ݣ�һ�ݼ�������ϡ���ᣬ��һ�ݼ�������NaOH��Һ��ͬ��ͬѹ�²��������������Ϊ3��2������Ʒ�����������ʵ���֮��Ϊ( )
A.3��2B.2��1C.3��4D.4��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����Ӧ����������ʵ����
|
|
|
|
A����������̼����ͨ��CaCl2��Һ�����������ɫ���� | B���ü��������Fe(OH)3���壬�����������ЧӦ�� | C����ʪ�����ɫ��������ʢ�и���������ƿ�У���������ɫ | D�����ι��е�Ũ�������̼��������Һ�����������С��� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��Ϊ��֤�����������������Ư���ԣ����������ͼ��ʾ��ʵ��װ�ã�
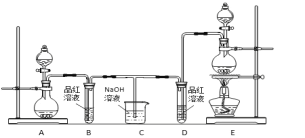
�����Ʊ�������������������ݵ�ԭ���ֱ��ǣ�
Na2SO3+H2SO4 = Na2SO4+H2O+SO2��
MnO2+4HCl(Ũ) ![]() MnCl2+2H2O+Cl2��
MnCl2+2H2O+Cl2��
(1)������ȡ������װ����______(����ĸ)����Ӧ��Ũ���������ֳ�________________���ʡ�
(2)��Ӧ��ʼһ��ʱ���B��D�Թ��е�Ʒ����Һ����ɫ��ֹͣͨ�����ٸ�B��D�����Թֱܷ����____ (��" B������D")�Թ�������������
(3)װ��C��������________________________��
(4)��װ��D�е�Ʒ����Һ������ɫ��ʯ����Һ������ֵ�������____________________________��
(5)��С��ͬѧ�����������Ϻ�ͨ��Ʒ����Һ��һ��ʱ���Ʒ����Һ��������ɫ���������ϵ�֪���������尴�����1:1��ϣ�����ˮ��Ӧ���������ֳ������ᣬ���ʧȥƯ�����ã��÷�Ӧ�Ļ�ѧ����ʽ�ǣ�________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ������ͼ��ʾ�����ڸ÷�Ӧ������˵���в���ȷ����(����)
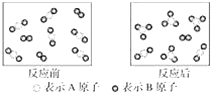
A. �÷�ӦΪ���淴Ӧ
B. �÷�Ӧ�ɱ�ʾΪ2AB2��B2![]() 2AB3
2AB3
C. ����Ӧ��ʼ����1 mol B2���������2 mol AB3
D. �ù����У��ѷ�Ӧ��AB2ռAB2������![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com