
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
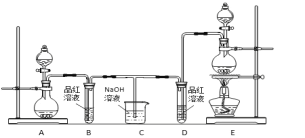
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______(填字母),反应中浓盐酸所表现出________________性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均退色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不退色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________。
【答案】E 还原性、酸性 D 吸收多余的SO2和Cl2 紫色石蕊试液先变红后褪色 SO2+Cl2+2H2O═2HCl+H2SO4
【解析】
(1)根据反应物的状态和反应条件选择反应装置,根据氯元素的化合价判断其表现的性质;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;
(3)二氧化硫、氯气都有毒,不能排放在环境中.用NaOH溶液吸收二氧化硫生成氯化钠与次氯酸钠;
(4)次氯酸既有酸性又有漂白性,所以氯气通入紫色石蕊试液中现象是先变红后褪色;
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性。
(1)实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,故选E;实验室制取氯气的反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性,故答案为:E;还原性、酸性;
MnCl2+Cl2↑+2H2O,由HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性,故答案为:E;还原性、酸性;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,故答案为:D;
(3)氯气和二氧化硫有毒,不能排放到空气中,但氯气和二氧化硫都和碱反应,所以装置C的作用是吸收多余的氯气和二氧化硫,故答案为:吸收多余的SO2和Cl2;
(4)次氯酸既有酸性又有漂白性,所以氯气通入紫色石蕊试液中现象是先变红后褪色,故答案为:紫色石蕊试液先变红后褪色;
(5)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应:SO2+Cl2+2H2O═2HCl+H2SO4 生成无漂白性的H2SO4和HCl,故答案为:SO2+Cl2+2H2O═2HCl+H2SO4。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0molL﹣1稀硫酸,
(1)需量取浓硫酸的体积为_____mL。
(2)配制溶液时,一般可以分为以下几个步骤:①量取 ②计算 ③溶解 ④颠倒摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为________________,本实验必须用到的仪器有量筒、玻璃棒、烧杯、胶头滴管、还有___________。
(3)在配制过程中,下列操作会引起浓度偏高的是____,无影响的是____(填序号)。
①没有洗涤烧杯和玻璃棒;
②转移溶液时不慎有少量洒到容量瓶外面;
③容量瓶不干燥,含有少量蒸馏水;
④定容时俯视刻度线;
⑤未冷却到室温就将溶液转移到容量瓶并定容;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
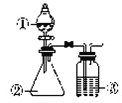
选项 | ① | ② | ③ | 实验结论 |
A | 酸性高锰酸钾 | 浓盐酸 | NaHCO3溶液 | Cl2与水反应生成酸性物质 |
B | 浓硫酸 | 蔗糖 | 澄清石灰水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | 铁片 | NaOH溶液 | 铁和浓硝酸反应可生成NO |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CuO![]() 2Cu2O+O2↑,关于该反应的叙述不正确的是
2Cu2O+O2↑,关于该反应的叙述不正确的是
A. 固体的颜色由黑色变为红色
B. 铜元素被还原,氧元素部分被氧化
C. 16 g氧化铜分解时转移电子0.2 mol
D. 可说明热稳定性:氧化铜>氧化亚铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
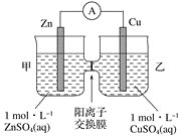
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池中硫酸根的浓度减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。
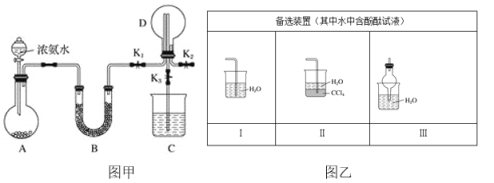
(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。

(1)试管①中反应的化学方程式是______;
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是______;
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有______性。
(3)试管③中的试剂为NaOH溶液,其作用是______,反应的离子方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com