
����Ŀ��ij��ѧ��ȤС������ͼ��װ����ȡ������̽���������й����ʡ�
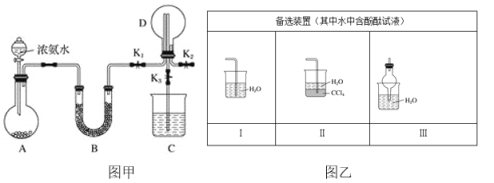
��1��װ��A����ƿ���Լ���ѡ��__������ţ���
a����ʯ�ҡ�b��Ũ���ᡡc�����������ס�d���Ȼ���
��2����̽���������ܽ��ԣ���װ��D�м��������ر�K1��K2����K3��������Ȫ��ʵ�������__��������K2�ĵ���ĩ������ͼ���е�__װ�ã�����ţ���
��3����̽�������Ļ�ԭ�ԣ���ر�K1��K3��K2���Ӵ���������������װ�á�
���ö���������Ũ������ȡ���������ɵ������������ͨ��ʢ��__�Լ���__�Լ���ϴ��ƿ��
��D�а�����������Ӧ�������̣�ͬʱ����һ����ɫ��ζ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ__��
��β������Cװ�ô�������β���к�������Cl2����Cװ����Ӧʢ��__��Һ���ѧʽ������Ӧ�����ӷ���ʽΪ__��
���𰸡�a ����ë����סԲ����ƿ�ײ�����C �е����е�ˮ����C��ˮ��ʱ������ë������������Ȫ �� ����ʳ��ˮ Ũ���� 3Cl2+8NH3![]() 6NH4Cl+N2 NaOH Cl2+2OH��
6NH4Cl+N2 NaOH Cl2+2OH��![]() Cl��+ClO��+H2O
Cl��+ClO��+H2O
��������
(1)��ˮ�ӷ��������¶��ܴٽ���ˮ�ֽ����ɰ�����Ϊ�ٽ���ˮ�ֽ⣬����ƿ�м������������ˮ���ܷų������ȣ��ҺͰ�ˮ����Ӧ��
(2)������������ˮ���ر�K1��K2����K3������ѹǿ��ձ��е�ˮ�ŵ���ƿ�У���K2�ĵ���ĩ������ͼ���е��ܷ�ֹ������װ�ã�
(3)��Ũ������ȡ�������к����Ȼ��������ˮ����,Ϊ��ֹ����ʵ��,�����ڽ�����ƿǰ,Ӧ���ñ���ʳ��ˮ��Ũ�����ȥ�Ȼ����ˮ������
�ڸ���������ԭ��Ӧ֪, ������������Ӧ�����������Ȼ�泥����ɵ���ɫ��ζ�������ǵ���,���ݷ�Ӧ���������д����Ӧ����ʽ��
��������ˮ��Һ������,���Կ����ü��ȥ������
(1)��ˮ�ӷ�,�����¶��ܴٽ���ˮ�ֽ����ɰ���,Ϊ�ٽ���ˮ�ֽ�,����ƿ�м������������ˮ���ܷų�������,�ҺͰ�ˮ����Ӧ��
a.��ʯ����ˮ�ų�������,��ʹ��ˮ�¶�����,�ҺͰ�ˮ����Ӧ,��aѡ;��
b.Ũ����Ͱ�ˮ��Ӧ,��b��ѡ��
c.�����������ܺͰ�ˮ��Ӧ,��c��ѡ��
d.�Ȼ��ƺͰ�ˮ��Һ�а�����Ӧ���������,�ܽⲻ����,��d��ѡ,��
������ǣ�a��
(2)����ѹǿ��ձ��е�ˮ�ŵ���ƿ�У�����Ϊ����ë������ƿ����,��ƿ�е���������ձ��У����´���ѹǿ������ƿ������ѹǿ���Ӷ�ʹ�ձ��е�ˮͨ�����ܽ�����ƿ�в�����Ȫʵ�飬������������ˮ,Ϊ��ֹ����,���հ�����װ����Ӧ���л���װ��,��װ���ж��л���װ��,��û�л���װ���ܲ�������,������K2�ĵ���ĩ������ͼ���е� I��
������ǣ�����ë����סԲ����ƿ�ײ�����C �е����е�ˮ����C��ˮ��ʱ������ë������������Ȫ����
(3)��Ũ������ȡ�������к����Ȼ��������ˮ������Ϊ��ֹ����ʵ��,�����ڽ�����ƿǰ��Ӧ���ñ���ʳ��ˮ��Ũ�����ȥ�Ȼ����ˮ������
�����Ϊ������ʳ��ˮ��Ũ����;��
�ڸ���������ԭ��Ӧ֪,���ɵ���ɫ��ζ�������ǵ���,�����䷴Ӧ����ʽΪ��3Cl2![]() 8NH3=6NH4Cl
8NH3=6NH4Cl![]() N2,
N2,
�������3Cl2![]() 8NH3=6NH4Cl
8NH3=6NH4Cl![]() N2��
N2��
��������ˮ��Ӧ��������ʹ����ᵼ��������ˮ��Һ������,���Կ���������������Һ��ȥ����,��Ӧ���ӷ���ʽΪ��Cl2![]() 2OH-=Cl-
2OH-=Cl-![]() ClO-
ClO-![]() H2O��
H2O��
�������NaOH��Cl2![]() 2OH-=Cl-
2OH-=Cl-![]() ClO-
ClO-![]() H2O��
H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���dz�����Ҫ��Ⱦ֮һ��������һ�ְ취����������������װ��ת��������ʹһ��������һ����̼��Ӧ���ɿɲ��������̬ѭ���������壬����ʹ������ȼ�ռ����������ת��������˵���������
A. һ��������һ����̼��Ӧ�Ļ�ѧ����ʽΪ2CO��2NO![]() 2CO2��N2
2CO2��N2
B. �˷�����ȱ�������ڶ�����̼�����࣬������߿��������
C. Ϊ���ٳ�����ȾӦ��������Դ
D. ����β����������������Ѫ�쵰��϶�ʹ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��Ϊ��֤�����������������Ư���ԣ����������ͼ��ʾ��ʵ��װ�ã�
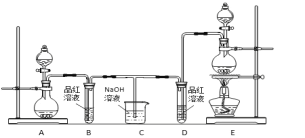
�����Ʊ�������������������ݵ�ԭ���ֱ��ǣ�
Na2SO3+H2SO4 = Na2SO4+H2O+SO2��
MnO2+4HCl(Ũ) ![]() MnCl2+2H2O+Cl2��
MnCl2+2H2O+Cl2��
(1)������ȡ������װ����______(����ĸ)����Ӧ��Ũ���������ֳ�________________���ʡ�
(2)��Ӧ��ʼһ��ʱ���B��D�Թ��е�Ʒ����Һ����ɫ��ֹͣͨ�����ٸ�B��D�����Թֱܷ����____ (��" B������D")�Թ�������������
(3)װ��C��������________________________��
(4)��װ��D�е�Ʒ����Һ������ɫ��ʯ����Һ������ֵ�������____________________________��
(5)��С��ͬѧ�����������Ϻ�ͨ��Ʒ����Һ��һ��ʱ���Ʒ����Һ��������ɫ���������ϵ�֪���������尴�����1:1��ϣ�����ˮ��Ӧ���������ֳ������ᣬ���ʧȥƯ�����ã��÷�Ӧ�Ļ�ѧ����ʽ�ǣ�________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ͼ��ʾ��װ�ü�ҩƷ��������ǿ���Ƚϵ�ʵ�飬����˵������ȷ����
A���������з����ķ�Ӧ��Ϊ���ֽⷴӦ
B����Na2SiO3������Һ�еη�̪��Һ����������
C��һ��ʱ��������н���״��������
D����ʵ����֤������ǿ����˳���ǣ����̼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84������Һ����Ч�ɷ�Ϊ![]() ��������������Ư�ף�����ʵ������ķ�������ȷ����
��������������Ư�ף�����ʵ������ķ�������ȷ����
ʵ����� | ��
| �� | ��
|
ʵ������ | ��Ϻ���Һ�� | ��Ϻ���Һ | ��Ϻ���Һ |
A. �Ա�ʵ��ٺ͢ڣ�������ɫѸ����ȥ��ԭ���Ƿ����˷�Ӧ![]()
B. ʵ����в�����������![]() ����
����![]() �ֽ�õ���
�ֽ�õ���![]()
C. �Ա�ʵ��ںۣ͢���Һ��![]() ���ܻ�Ӱ��
���ܻ�Ӱ��![]() �������Ի�
�������Ի�![]() �Ļ�ԭ��
�Ļ�ԭ��
D. ������������84������Һ��Ư��Ч��������Ҫ���ص����ʵ�![]() ���ܰ�ȫʹ��
���ܰ�ȫʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ��(�г�װ��δ����)����ʵ�顣��ش��������⣺
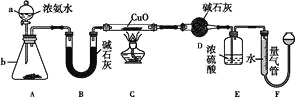
(1)����a������Ϊ____������b�п�ѡ����Լ�Ϊ____��
(2)ʵ������,����װ��A��������ȡ����ɫ������____(����ĸ)��
A��Cl2 | B��O2 | C��CO2 | D��NO2 |
(3)ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�������������������֤��NH3����____��,д����Ӧ�Ļ�ѧ����ʽ:_______________________��
(4)Eװ����Ũ�����������_____________________________________��
(5)��ȡ�������ǰ��Ӧ��װ��F���еIJ�����____________________________��
(6)ʵ����ϣ�����ø����D����m g��װ��F�����������Ϊn L��������ɱ�״�����������е������ԭ�Ӹ�����Ϊ____���ú�m��n��ĸ�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ������ͼ��ʾ�����ڸ÷�Ӧ������˵���в���ȷ����(����)
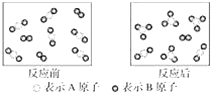
A. �÷�ӦΪ���淴Ӧ
B. �÷�Ӧ�ɱ�ʾΪ2AB2��B2![]() 2AB3
2AB3
C. ����Ӧ��ʼ����1 mol B2���������2 mol AB3
D. �ù����У��ѷ�Ӧ��AB2ռAB2������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����Ͷ�������Ĵ������ϵͳ���ŵ�ǰ����Ĥ�����ĵ����ΪNa2S2��NaBr3���ŵ��ֱ��ΪNa2S4��NaBr������������ȷ���ǣ� ��
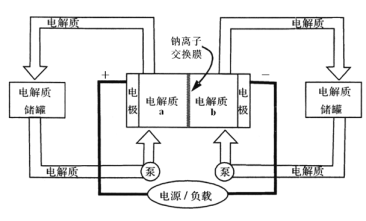
A. �ŵ�ʱ��������ӦΪ3NaBr��2e-=NaBr3+2Na+
B. ���ʱ��������ӦΪ2Na2S2��2e-=Na2S4+2Na+
C. �ŵ�ʱ��Na+�������ӽ���Ĥ����b������a��
D. �øõ�ص�ⱥ��ʳ��ˮ������2.24 L H2ʱ��b������17.40gNa2S4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���㡢Ϻ������С�ӱ������������ס��ҡ�������(��ͼ)�������ų��ķ�Һ�ÿ������ֻ�� Na2CO3��CuCl2��Ca(OH)2��HCl �е�һ�֡�ij��ѧ����С��Ժ�ˮ���ʱ���֣��� �״���ˮ�����ҳ���ɫ���� �Ҵ���ˮ�����ɫ���DZ�dz��ɫ���ǣ��� ������ˮ�ɻ���壻�� �����������ݣ���ˮ���壬���ƶϣ�
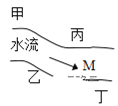
(1)���������ų��ķ�Һ�ﺬ�е���Ⱦ���_______����________����_______����________��
(2)��M��ȡ���ĺ�ˮ�У��϶����е�������____________________��
(3)д�����������ܷ��������ӷ���ʽ______________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com