
【题目】为确定某NH4NO3和(NH4)2SO4混合物的组成,称取4份样品分别加入50.0mL相同浓度的NaOH溶液中,加热充分反应(加热后氨气全部逸出)。加入的混合物的质量和产生的气体体积(标准状况)的关系如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
NaOH溶液体积(mL) | 50.0 | 50.0 | 50.0 | 50.0 |
样品质量(g) | 3.44 | m | 17.2 | 21.5 |
NH3体积(L) | 1.12 | 2.24 | 5.60 | 5.60 |
试计算:
(1)m=________g;c(NaOH)=___________ mol·L-1
(2)样品中NH4NO3和(NH4)2SO4物质的量之比为______________。
【答案】6.88g 5.00 1:2
【解析】
发生反应有:(NH4)2SO4+2NaOH ![]() Na2SO4+2NH3↑+2H2O、NH4NO3+NaOH
Na2SO4+2NH3↑+2H2O、NH4NO3+NaOH ![]() NaNO3+NH3↑+H2O;由表可知,Ⅰ、Ⅱ中氢氧化钠过量,而当生成氨气5.6L时,所需固体的质量为:
NaNO3+NH3↑+H2O;由表可知,Ⅰ、Ⅱ中氢氧化钠过量,而当生成氨气5.6L时,所需固体的质量为: ![]() =17.2g,所以Ⅲ中混合物与氢氧化钠恰好完全反应,IV中氢氧化钠不足。
=17.2g,所以Ⅲ中混合物与氢氧化钠恰好完全反应,IV中氢氧化钠不足。
(1)氢氧化钠过量时,生成气体的量与固体混合物成正比,所以m= ![]() =6.88g,由于III中两者恰好完全反应,因此n(NaOH)=n(NH3)=5.6L÷22.4L/mol=0.25mol,所以c(NaOH)=0.25mol÷0.05L=5molL﹣1;
=6.88g,由于III中两者恰好完全反应,因此n(NaOH)=n(NH3)=5.6L÷22.4L/mol=0.25mol,所以c(NaOH)=0.25mol÷0.05L=5molL﹣1;
(2)设NH4NO3的物质的量为xmol,(NH4)2SO4的物质的量为ymol,则x+2y=0.25、80x+132y=17.2,解得x=0.05、y=0.1,因此样品中NH4NO3和(NH4)2SO4物质的量之比为1:2。


科目:高中化学 来源: 题型:
【题目】下列说法合理的是
①根据纯净物中是否含氧元素,来判断是否属于氧化物
②根据电泳现象可证明胶体带电荷
③直径介于lnm~l00nm之间的微粒称为胶体
④金属氧化物都是碱性氧化物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液
⑥同一钢笔使用不同牌号的墨水容易堵塞,是由于胶体的聚沉
A. 只有⑥ B. 只有②⑥ C. 只有③④⑤ D. 只有①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的一种,阴离子分别是NO![]() 、SO
、SO![]() 、Cl-、CO
、Cl-、CO![]() 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色;
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题。
(1)写出A、C的化学式:A________________,C_______________。
(2)写出盐酸与D反应的离子方程式:_________________________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)含有相同碳原子数的CO和CO2,其质量比为________。
(2)标准状况下有①44.8L CH4,②9.03×1023个NH3分子,③85g H2S三种气体,这三种气体的物质的量从大到小的顺序是________。
(3)若1g CO2中含有x个原子,则阿伏加德罗常数可表示为________。
(4)4.9g H2SO4含________个H2SO4分子,能和________mol NaOH完全反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
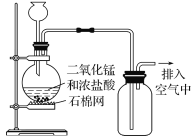
【题目】Cl2是中学化学重要气体之一,实验室常用二氧化锰与浓盐酸反应制取Cl2。请回答下列问题:
Ⅰ实验室用二氧化锰制取Cl2的化学方程式为______________________________,如图所示制取氯气装置中至少存在_____________明显错误。
Ⅱ实验室也可用高锰酸钾与浓盐酸反应制取Cl2,并收集和检验Cl2的性质。
已知:①KMnO4在不加热的条件下可与浓盐酸发生反应制取Cl2。
②无水CaCl2可吸收水蒸气。
(1)将反应原理补充完整:2KMnO4+16HCl(浓)=________+5Cl2↑+8H2O。
(2)选择实验装置,完成相应的实验:
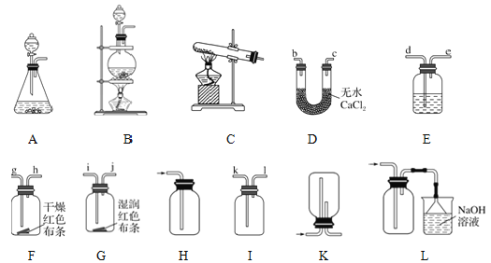
①若制取、收集干燥纯净的Cl2,按装置连接顺序可以选择其中的______(填序号)进行实验。
②若按A-E-D-F-G-L顺序连接装置进行实验,可得出的实验结论是___________。
③在上述实验①和②中,制取氯气前必须进行的一项操作是______,装置E中的试剂是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]3H2O为绿色晶体,易溶于水,难溶于乙醇、丙酮等有机溶剂。
I.三草酸合铁(Ⅲ)酸钾晶体的制备
①将5g(NH4)2Fe(SO4)2·6H2O晶体溶于20mL水中,加入5滴6 mol·L-1H2SO4酸化,加热溶解,搅拌下加入25mL饱和H2C2O4溶液,加热,静置,待黄色的FeC2O4沉淀完全以后,倾去上层清液,倾析法洗涤沉淀2-3次。
②向沉淀中加入10mL饱和草酸钾溶液,水浴加热至40℃,用滴管缓慢滴加12mL5%H2O2,边加边搅拌并维持在40℃左右,溶液成绿色并有棕色的沉淀生成。
③加热煮沸一段时间后,再分两批共加入8mL饱和H2C2O4溶液(先加5mL,后慢慢滴加3mL)此时棕色沉淀溶解,变为绿色透明溶液。
④向滤液中缓慢加入10mL95%的乙醇,这时如果滤液浑浊可微热使其变清,放置暗处冷却,结晶完全后,抽滤,用少量洗涤剂洗涤晶体两次,抽干,干燥,称量,计算产率。
已知制备过程中涉及的主要反应方程式如下:步骤②6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3,步骤③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O,请回答下列各题:
(1)简述倾析法的适用范围______________,步骤③加热煮沸的目的是_______________。
(2)下列物质中最适合作为晶体洗涤剂的是____________________(填编号)。
A.冷水 B.丙酮 C.95%的乙醇 D.无水乙醇
(3)有关抽滤如图,下列说法正确的是_____________。

A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.右图所示的抽滤装置中,只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
Ⅱ.纯度的测定
称取1.000g产品,配制成250mL溶液,移取25.00mL溶液,酸化后用标定浓度为0.01000 mol·L-1的高锰酸钾溶液滴定至终点,三次平行实验平均消耗高锰酸钾溶液24.00mL。
(4)滴定涉及反应的离子方程式:___________________________________。
(5)计算产品的纯度_____________________(用质量百分数表示)。(K3[Fe(C2O4)3]·3H2O的相对分子质量为491)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有()
A.CO2、NO2均为酸性氧化物,CaO、Na2O2均为碱性氧化物
B.Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应和复分解反应来制取Fe(OH)3
C.灼热的炭与CO2反应、![]() 与
与![]() 的反应均可设计成原电池
的反应均可设计成原电池
D.电解、电泳、电离、电镀、电化学腐蚀过程均需要通电才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0molL﹣1稀硫酸,
(1)需量取浓硫酸的体积为_____mL。
(2)配制溶液时,一般可以分为以下几个步骤:①量取 ②计算 ③溶解 ④颠倒摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为________________,本实验必须用到的仪器有量筒、玻璃棒、烧杯、胶头滴管、还有___________。
(3)在配制过程中,下列操作会引起浓度偏高的是____,无影响的是____(填序号)。
①没有洗涤烧杯和玻璃棒;
②转移溶液时不慎有少量洒到容量瓶外面;
③容量瓶不干燥,含有少量蒸馏水;
④定容时俯视刻度线;
⑤未冷却到室温就将溶液转移到容量瓶并定容;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com