
【题目】检验Cl―时所用试剂中稀HNO3的作用是 ( )
A. 防止CO32―的干扰B. 防止Cl―的干扰
C. 生成Ag2CO3沉淀D. 防止NO3―的干扰
科目:高中化学 来源: 题型:
【题目】下列现象与胶体知识无关的是
A.夏日的傍晚常常看到万丈霞光穿云而过美不胜收
B.向碳酸氢钠溶液中加入氯化钙溶液时溶液没有浑浊
C.食品加工厂利用豆浆中加入盐卤做豆腐
D.某化工厂利用静电除尘技术去除废气中的固体悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氮的固定的是( )
A.空气在雷电作用下产生一氧化氮B.一氧化氮和氧气反应生成二氧化氮
C.铜与浓硝酸反应产生二氧化氮D.氯化铵与氢氧化钙反应生成氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
② | 滴入淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
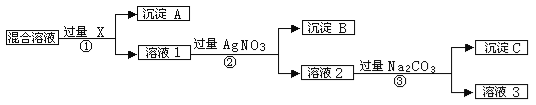
请回答下列问题:
⑴写出实验中下列物质的化学式:试剂X :_______,沉淀A:_______,沉淀B:______。
⑵上述实验流程中加入过量的Na2CO3的目的是___________________________________。
⑶按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________ ,之后若要获得固体NaNO3需进行的实验操作是________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列微粒中,只有氧化性的是_____________ (用字母填写,下同),既有氧化性又有还原性的是___________________。
A. Cl2 B. S2— C. H+ D. Na E. FeCl2
(2)在4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O反应中
MnCl2+Cl2↑+2H2O反应中
①氧化剂是________,氧化产物是________;
②被氧化与未被氧化的HCl的质量之比为_______,若有7.3gHCl被氧化,转移电子的物质的量为________;。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com