
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
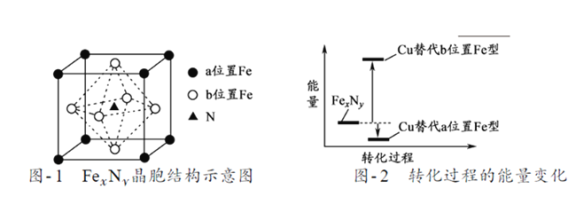
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。
【答案】 [Ar]3d5或 1s22s22p63s23p63d5 sp2和sp3 9 mol H<C<O 乙醇分子间存在氢键 Fe3CuN
【解析】(1)铁是26号,Fe3+基态核外电子排布式为[Ar]3d5或 1s22s22p63s23p63d5;(2)丙酮(![]() )分子中碳原子轨道的杂化类型是甲基中的C形成3个C―H σ键,1个C―C σ键,为sp3 杂化,羰基中的C形成3个C―C σ键,一个π键,故C的杂化方式为sp2;据以上分析1 mol 丙酮分子中含有σ键的数目为9 mol;(3)C、H、O 三种元素的电负性由小到大的顺序为H<C<O;(4)乙醇的沸点高于丙酮,这是因为乙醇分子间存在氢键;丙酮分子中无与电负性较大的O原子相连的H原子,不能形成氢键;(5)a位置Fe:8×1/8=1,b位置Fe,6×1/2=3,N为1个,从题21图-2看出:Cu替代a位置Fe型产物的能量更低,将化学式由Fe3FeN用铜替换为Fe3CuN。
)分子中碳原子轨道的杂化类型是甲基中的C形成3个C―H σ键,1个C―C σ键,为sp3 杂化,羰基中的C形成3个C―C σ键,一个π键,故C的杂化方式为sp2;据以上分析1 mol 丙酮分子中含有σ键的数目为9 mol;(3)C、H、O 三种元素的电负性由小到大的顺序为H<C<O;(4)乙醇的沸点高于丙酮,这是因为乙醇分子间存在氢键;丙酮分子中无与电负性较大的O原子相连的H原子,不能形成氢键;(5)a位置Fe:8×1/8=1,b位置Fe,6×1/2=3,N为1个,从题21图-2看出:Cu替代a位置Fe型产物的能量更低,将化学式由Fe3FeN用铜替换为Fe3CuN。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的

A.Cu为正极,Ag2O为负极
B.电池工作时,OH—向正极移动
C.正极的电极反应为:2Cu+2OH——2e—=Cu2O+H2O
D.外电路中每通过2mol电子,正极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应 aA(g) ![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的物质的量变多 D. 再次平衡时的逆反应速率小于原平衡的正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)
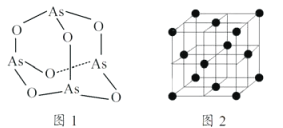
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com