
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)
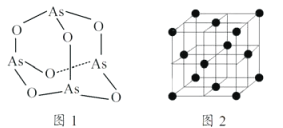
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
【答案】4p As>Se>Ge 高 NH3分子间存在氢键 ABCE sp3 PO43-或SO42-或ClO4- 4 ![]()
【解析】
(1)根据构造原理,基态As原子核外电子排布中能级最高的是4p,As的4p能级处于半充满状态,第一电离能比相邻同期元素均大,与As同周期且相邻原子的第一电离能由大到小的顺序为As>Se>Ge。
(2)根据分子晶体影响沸点的因素分析;
(3)NH5是离子化合物,含有离子键和共价键,以此分析。
(4)根据杂化轨道理论判断中心As的杂化方式;原子总数和价电子总数相同的称为等电子体。
(5)根据均摊法可知,晶胞中P4分子数目为4,则晶胞中含有16个P原子,计算晶胞质量,再根据ρ=m/V计算晶胞密度。
(1)根据构造原理,基态As原子核外电子排布中能级最高的是4p,As的4p能级处于半充满状态,第一电离能比相邻同期元素均大,与As同周期且相邻原子的第一电离能由大到小的顺序为As>Se>Ge。
(2)NH3的沸点比PH3高,原因是NH3分子间存在氢键,相对分子质量对沸点的影响占次要地位。
(3)NH5中所有原子最外层都满足稳定结构,其中N与H形成共价键,是σ键,4个共价键中有一个是配位键,NH4+与H-之间形成离子键,则NH5中含有的化学键类型为A B C E 。
(4)价电子对数=3+(5-1×3)/2=4,VSEPR模型为四面体,所以其空间构型为正四面体,根据杂化轨道理论,中心As的杂化方式为sp3,原子总数和价电子总数相同的称为等电子体,与AsO43-互为等电子体的微粒是PO43-或SO42-或ClO4- ;
(5)根据均摊法可知,晶胞中P4分子数目为8×1/8+6×1/2=4,则晶胞中P原子数目为4×4=16,晶胞质量为16×31/NAg,晶胞体积为(a×10-7 cm)3,则晶胞密度为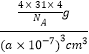 g·cm-3,即:
g·cm-3,即:![]() g·cm-3
g·cm-3


科目:高中化学 来源: 题型:
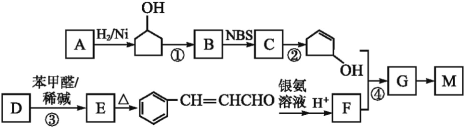
【题目】有机高分子材料M的结构简式为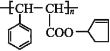 ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
已知:①A分子中有两种不同环境的氢原子
②CH3CH2CH![]() CH2
CH2![]() CH3CHBrCH
CH3CHBrCH![]() CH2
CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH
CH3CH![]() CHCHO+H2O
CHCHO+H2O
请回答以下问题:
(1)A的结构简式为____,B的名称为____,F中所含官能团的名称是__________。
(2)①和③的反应类型分别是____、____;反应②的反应条件为_____________。
(3)反应④的化学方程式为_____________________________________________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有___种。
①属于芳香酯类 ②其酸性水解产物遇FeCl3显紫色
(5)以1-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
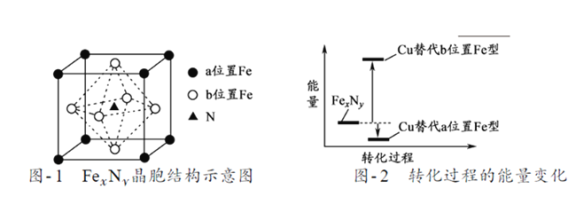
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1L0.5mol·L-1NH4C1溶液中含有NH4+的数目为0.5NA
B. 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA
C. 32g18O2中含有的氧原子数是2NA
D. 质量均为78g的Na2O2和Na2S固体,其离子总数均为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
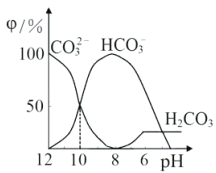
A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛萦洛芬钠的关键中间体,它的一种合成路线如下:
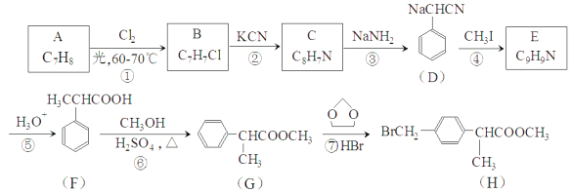
(1)A的物质名称为___________,H中官能团名称是___________。
(2)E的结构简式为___________,反应②的反应类型为___________。
(3)反应①的化学方程式为___________,反应⑥的化学方程式为___________。
(4)写出满足下列条件的F的同分异构体的结构简式___________。
I.能发生水解反应生成酸和醇
Ⅱ.能发生银镜反应
Ⅲ.核磁共振氢谱有5组峰且峰面积之比为3:2:2:2:1
(5)仿照H的合成线,设计一种由![]() 合成
合成![]() 的合成路线______________________。
的合成路线______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是____mol/L,含NaOH的质量____g。
(2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则:
①混合气体的密度是_____。
②混合气体的平均摩尔质量是______。
③CO2和CO的体积之比是_______。
④CO的体积分数是______。
⑤CO2和CO的质量之比是_______。
⑥CO的质量分数是______。
⑦混合气体中所含氧原子的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
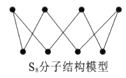
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 粗铜精炼中,外电路转移电子数为NA时,阳极质量减小32g
B. 5.6gFe与足量的硫充分反应,转移电子数为0.3NA
C. 室温下,醋酸铵的水溶液呈中性,溶液中所含H+数目为10-7NA
D. S8分子结构如图,1mol该分子中含有S—S键个数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com