
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
【答案】B
【解析】试题分析:恒温恒容,甲与乙起始n(SO2):n(O2)=2:1,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,转化率增大;丙按化学计量数转化到左边可得n(SO2)=2mol,n(O2)=1mol,与甲为等效平衡,平衡时对应各组分的物质的量相等。A、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故压强P甲=P丙,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故P乙<P甲<2P乙,故P甲=P丙<2P乙,A错误;B、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故质量m甲=m丙,甲等效为在乙到达平衡的基础上,再加入1mol SO2和0.5mol O2,增大压强,平衡向正反应移动,SO2转化率增大,m甲>2m乙,故m甲=m丙>2m乙,B正确;C、对于甲、乙,SO2、O2起始物质的量之比等于化学计量数之比,c(SO2)与c(O2)之比为定值2:1,丙为分解反应,丙中c(SO2)与c(O2)之比为2:1,故k甲=k丙=k乙=2,C错误;D、甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故Q甲+Q丙=197,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,SO2转化率增大,故Q甲>2Q乙,D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】我国空气质量预报的内容主要包括三个方面:二氧化硫、氮氧化物(NOx)、悬浮颗粒物等三种大气污染物的浓度。
(1)①与氮氧化物有关的全球或区域性大气环境问题有______________(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d. 温室效应
②悬浮颗粒物可用高压电除尘,是利用了 现象
(2)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置。它能将尾气中的一氧化碳和NO在催化剂作用下,发生反应转化为无害气体,其反应的化学方程式为 。
(3)①写出实验室中由固体物质制取氨气的化学方程式 ;
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)

③实验室也可用下图所示装置制取氨气。烧瓶内固体可选用____________(选填选项的代号)。
a.碱石灰 b.生石灰 c.二氧化硅 d.五氧化二磷

④催化剂存在下,NH3也可用来消除NOx的污染,生成两种对环境无害的物质,请写出NH3与NO2反应的化学方程式为 ,该反应中每生成0.5molN2转移 mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.浓硫酸使胆矾晶体变白(脱水性)
B.在加热条件下铜与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(不挥发性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, 则此时 V正_____ V逆(填“ > ”、“=”或“<”)。
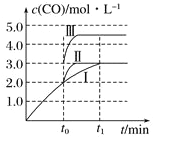
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________________。
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下, 将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
(Ⅱ)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系_________________________ ;
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.氧化铜与盐酸反应O2―+2H+=H2O
B.二氧化碳通入足量氢氧化钠溶液中:CO2+OH-=HCO3-
C.铝片与硫酸铜溶液反应:2Al+3Cu2+=2Al3++3Cu
D.氢氧化钡溶液与稀H2SO4反应:H++OH-+Ba2++SO42-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然产物水解的叙述不正确的是
A. 纤维素水解与淀粉水解得到的最终产物不同
B. 可用碘检验淀粉水解是否完全
C. 蛋白质水解的最终产物均为氨基酸
D. 油脂水解可得到丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200 mL 1 mol/L的氯化铝溶液中加入一定体积的2 mol/L的NaOH溶液,最终产生7.8 g沉淀,则加入的NaOH溶液的体积可能是( )
① 350 mL ② 90 mL ③ 150 mL ④200 mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应 A2(g) +B2(g)=2AB(g) ΔH,其能量变化如图所示,下列叙述正确的是
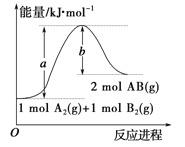
A. 断裂 1 mol A2 和 1 mol B2 中的化学键,放出a kJ 能量
B. ΔH=+(a-b)kJ·mol-1
C. 每生成 2 个AB分子吸收 b kJ 热量
D. 该反应中反应物的总能量高于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com