
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 粗铜精炼中,外电路转移电子数为NA时,阳极质量减小32g
B. 5.6gFe与足量的硫充分反应,转移电子数为0.3NA
C. 室温下,醋酸铵的水溶液呈中性,溶液中所含H+数目为10-7NA
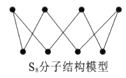
D. S8分子结构如图,1mol该分子中含有S—S键个数为8NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的

A.Cu为正极,Ag2O为负极
B.电池工作时,OH—向正极移动
C.正极的电极反应为:2Cu+2OH——2e—=Cu2O+H2O
D.外电路中每通过2mol电子,正极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)
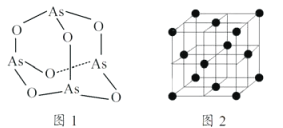
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和焦炭反应生成的产物中含有CO2、SO2、H2O。请回答下列问题:
(1)写出反应的化学方程式______________;
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2、SO2、H2O(g),按气流的方向,各装置的连接顺序是:______。(填序号)

(3)实验时若观察到:①中A瓶溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色, 则A 瓶的作用是______,B瓶的作用是______,C瓶的作用是_______。
(4)装置③中所盛溶液的名称是______,它可以用来验证的气体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别植物油和矿物油的正确方法是( )
A.加酸性高锰酸钾溶液,振荡
B.加NaOH溶液,煮沸
C.加新制Cu(OH)2悬浊液,煮沸
D.加溴水,振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的质量数为293,核电荷数为118,其核内中子数和核外电子数分别为( )
A. 118 175B. 118 118C. 193 118D. 175 118
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=12的稀氨水,下列叙述不正确的是
A. 溶液中c (OH-)=1.010-2 mol·L-1
B. 由水电离出的c (OH-)=1.010-12 mol·L-1
C. 加水稀释后,氨水的电离程度增大
D. 加入少量NH4Cl固体,溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
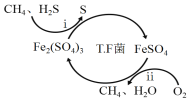
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
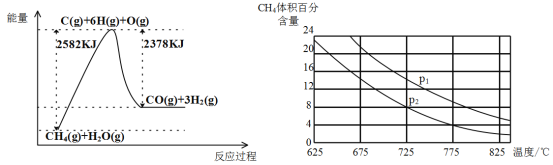
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
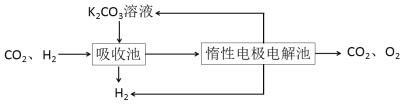
(4)吸收池中发生反应的离子方程式是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com