
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
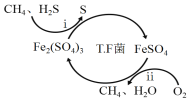
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
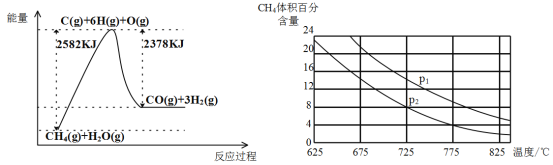
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
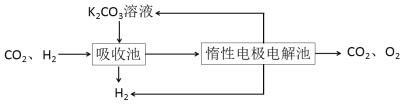
(4)吸收池中发生反应的离子方程式是____________________________________。
【答案】H2S+2Fe3+=2Fe2++S↓+2H+ 1.5 1.9 此范围既保证了Fe2+有较快的氧化速率又防止生成的Fe3+形成沉淀 CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol > 0.48 CO32-+CO2+H2O=2HCO3-
【解析】
(1)由图可知,过程中H2S变成S,S元素化合价由-2价变成0价,Fe3+被还原变成Fe2+,根据电子守恒写出离子反应方程式;
(2)由①可知Fe3+在pH=l.9时开始沉淀,会导致Fe3+浓度降低,则Fe2+ 和Fe3+浓度均会降低,速率降低,故pH应小于1.9。由②可知,pH在1.5的时候的氧化速率较快,故pH的取值范围是1.5<pH<1.9。
(3)①由图可知该反应为吸热反应,△H=2582kJ/mol-2378kJ/mol=+204kJ/mol,该过程的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol;
②由图可知,温度一定,压强也大,平衡逆向移动,则CH4的体积分数增大,则
P1 > P2。
③列出三行式,根据起始时混合气的密度是平衡时混合气密度的1.4倍,求出平衡时,CH4、H2O、CO、H2的浓度,再根据平衡常数K=![]() 计算。
计算。
(4)由图示已知吸收池中用的是K2CO3溶液,吸收CO2,以此书写离子方程式。
(1)由图可知,过程中H2S变成S,S元素化合价由-2价变成0价,Fe3+被还原变成Fe2+,根据电子守恒,过程i的离子反应方程式为H2S+2Fe3+=2Fe2++S↓+2H+;
因此,本题正确答案是:H2S+2Fe3+=2Fe2++S↓+2H+;
(2)由①可知Fe3+在pH=l.9时开始沉淀,会导致Fe3+浓度降低,则Fe2+ 和Fe3+浓度均会降低,速率降低,故pH应小于1.9。由②可知,pH在1.5的时候的氧化速率较快,故pH的取值范围是1.5<pH<1.9。
因此,本题正确答案是:1.5;1.9;此范围既保证了Fe2+有较快的氧化速率又防止生成的Fe3+形成沉淀;
(3)①由图可知该反应为吸热反应,△H=2582kJ/mol-2378kJ/mol=+204kJ/mol,该过程的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol;
②由图可知,温度一定,压强增大,平衡逆向移动,则CH4的体积分数增大,则
P1 > P2。
③列出三行式,设转化的CH4的物质的量为x,
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始(mol) 1 1 0 0
变化(mol) x x x 3x
平衡(mol)1-x 1-x x 3x
根据起始时混合气的密度是平衡时混合气密度的1.4倍,气体的总质量不变,密度与气体的总物质的量成反比,则![]() =1.4,解得x=0.4,
=1.4,解得x=0.4,
容器的容积为2L,则平衡时,CH4、H2O、CO、H2的浓度分别为:0.3mol/L、0.3mol/L、0.2mol/L、0.6mol/L,
则该反应的平衡常数为K=![]() =
=![]() =0.48。
=0.48。
因此,本题正确答案是:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+204kJ/mol;>;0.48;
(4)由图示已知吸收池中用的是K2CO3溶液,吸收CO2,则离子方程式是CO32-+CO2+H2O=2HCO3-,
因此,本题正确答案是:CO32-+CO2+H2O=2HCO3-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 粗铜精炼中,外电路转移电子数为NA时,阳极质量减小32g
B. 5.6gFe与足量的硫充分反应,转移电子数为0.3NA
C. 室温下,醋酸铵的水溶液呈中性,溶液中所含H+数目为10-7NA
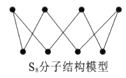
D. S8分子结构如图,1mol该分子中含有S—S键个数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列实验事实所引出的相应结论正确的是
选项 | 实验事实 | 结论 |
A | 其他条件相同,Na2S2O3与H2SO4反应时c(Na2S2O3)越大,析出S沉淀的时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
C | 物质的量浓度相同的盐酸和醋酸分别与等质量的、形状相同的锌粒反应 | 反应开始时速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是

A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素。![]()
请回答下列问题:
(1)T的离子结构示意图为______________;
(2)元素的非金属性为:Q_____________R(填“强于”或“弱于”);
(3)R元素的氢化物的电子式为________________;
(4)T的单质与同周期金属性最强元素最高价氧化物对应的水化物反应的离子方程式为______________________________________;
(5)T的单质与W的最高价氧化物的水化物浓溶液共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味。你猜想该气体是_________(填化学式),请你设计一个简单的实验方案证明你的猜想___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com