
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1L0.5mol·L-1NH4C1溶液中含有NH4+的数目为0.5NA
B. 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA
C. 32g18O2中含有的氧原子数是2NA
D. 质量均为78g的Na2O2和Na2S固体,其离子总数均为3NA
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】用CO 合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 温度:T1>T2>T3 B. 正反应速率:v(a)>v(c),v(b)>v(d)
C. 平衡常数:K(a)>K(c)>K(b)>K(d) D. 平均摩尔质量:M(a)>M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的

A.Cu为正极,Ag2O为负极
B.电池工作时,OH—向正极移动
C.正极的电极反应为:2Cu+2OH——2e—=Cu2O+H2O
D.外电路中每通过2mol电子,正极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应 aA(g) ![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的物质的量变多 D. 再次平衡时的逆反应速率小于原平衡的正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
(1)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br- → Br2转化的目的是_____,吸收塔中发生反应的离子方程式是________,
②从MgCl2溶液中得到MgCl2.6H2O晶体的主要操作是__________、_________、过滤、洗涤、干燥。
(2)![]()
①灼烧过程中用到的实验仪器有铁三角架、酒精灯、坩埚钳、_____、______。
②操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
③向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
④操作③是分液,则操作②是___________;操作④是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈尔滨医科大学附属第一医院张亭栋教授被认为最有可能获诺贝尔生理学或医学奖的学者之一,他是使用砒霜(As2O3)治疗白血病的奠基人,回答下列问题:
(1)基态As原子核外电子排布中能级最高的是___________,与As同周期且相邻原子的第一电离能由大到小的顺序为___________。
(2)NH3的沸点比PH3___________(填“高”或“低”),原因是___________。
(3)NH5中所有原子最外层都满足稳定结构,则NH5中含有的化学键类型为___________。
A、离子键 B、配位键 C、共价键 D、氢键 E、σ键 F、π键
(4)As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。与AsO43-互为等电子体的微粒是___________(写一种)
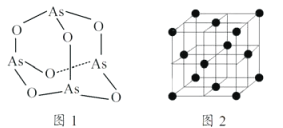
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小黑点表示白磷分子),已知晶胞的边长为anm,阿伏加德罗常数为 NAmol-1,则该晶胞中含有的P4分子数为___________,该晶体的密度为___________g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和焦炭反应生成的产物中含有CO2、SO2、H2O。请回答下列问题:
(1)写出反应的化学方程式______________;
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2、SO2、H2O(g),按气流的方向,各装置的连接顺序是:______。(填序号)

(3)实验时若观察到:①中A瓶溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色, 则A 瓶的作用是______,B瓶的作用是______,C瓶的作用是_______。
(4)装置③中所盛溶液的名称是______,它可以用来验证的气体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=12的稀氨水,下列叙述不正确的是
A. 溶液中c (OH-)=1.010-2 mol·L-1
B. 由水电离出的c (OH-)=1.010-12 mol·L-1
C. 加水稀释后,氨水的电离程度增大
D. 加入少量NH4Cl固体,溶液pH变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com