
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是()
A. 含K+为2mol的K2SO4溶液
B. 将58.5NaCl溶解于1L水中
C. 将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50克水的溶液
D. 将80gSO3溶于水并配成1L溶液
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为O2+2H2O+4e-===4OH-
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的SO2、SO3的物质的量之比为________;氧原子的个数之比为
________。
(2)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________;A的相对原子质量是____________;ACl2的化学式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 构成原电池的两个电极必须是活泼性不同的两种金属
B. 下图原电池中,电流由锌棒经外电路流向铜棒

C. 通过构成原电池,能将反应的化学能全部转化为电能
D. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
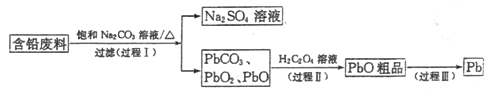
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见如图。
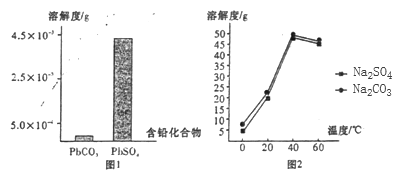
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据如图,解释可能原因:
i.温度降低,反应速率降低; ii.______________(请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是___________。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式__________。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图。
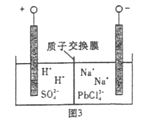
①阴极的电极反应式是____________。
②电解一段时间后,PbCl42-浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为________ mol·L-1。(假设电解前后硫酸溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z)。X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是

A. 工业上常用电解乙制备X
B. 甲、乙、丙均能与水发生化合反应
C. X为第二周期IIA族元素,Y和Z位于同一主族
D. X可用于制焰火烟花,Z可用作太阳能电池的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质)是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬产生的环境污染。铬渣综合利用工艺流程如下:

请回答下列问题:
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体,则生成Na2CrO4的反应方程式为_____ 。
(2)除去浸出液中的杂质最好加入_____(填试剂名称)来调节pH。除去铝元素的离子方程式为______________。
(3)理论上加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,工艺流程中不选用醋酸铅的原因是___________。
(4)铬酸铅是一种用于水彩和油彩的筑色颜料.遇到空气中的硫化物颜色会变然,该过积的化学反应方程式为_____________。
(5)实验室常利用Cr3+在碱性溶液中的还原性,使其转化为CrO42-,从而实现与Al3+的分离,这个过程中需要加入的试剂是__________(填化学式),分离操作是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com