
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是__________(填元素符号);
(3)K3AsO3可用于碘的微量分析。
①K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为____________。
②AsO33-的立体构型为________,写出一种与其互为等电子体的分子________
(填化学式)。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为____。

A. B.
B. C.
C. D.
D.
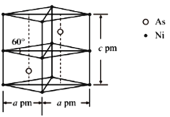
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
【答案】3d84s2 Fe N 电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量 三角锥形 PCl3、PBr3、NF3、NCl3等(答一种即可) Ni的原子半径较小,价层电子数目较多,金属键较强 C ![]()
【解析】
(1)镍是28号元素,根据构造原理写出电子排布式,根据钙、钾、铁和砷以及镍的核外电子排布式,找出未成对电子数最多的;
(2)非金属元素C、N、O、根据它们在周期表的位置,N的核外电子排布中,2p轨道为半充满,N的第一电离能高于同周期相邻的元素,判断第一电离能的大小;
(3).①电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量;
②AsO33-中As原子孤电子对数=![]() =1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;互为等电子体的微粒的原子总数相等、价电子总数也相等;
=1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型;互为等电子体的微粒的原子总数相等、价电子总数也相等;
(4).金属晶体熔沸点的高低与金属键的强弱有关,金属键的强弱与价层电子数目和金属原子的半径有关;
(5) ①镍的原子堆积方式为面心立方最密堆积;②由晶胞结构可知,每个晶胞中含有2个Ni原子和2个As原子,计算晶胞的质量,晶体密度=晶胞质量÷晶胞体积。
(1)镍是28号元素,根据构造原理写出简化的电子排布式[Ar] 3d84s2,
钙、钾、铁和砷以及镍的核外电子排布式:[Ar]4s2、[Ar]4s1、[Ar]3d64s2、[Ar]3d104s24p3、[Ar]3d84s2,未成对电子数分别为0、1、4、3、2,基态原子中,未成对电子数最多的是铁,
故答案为:[Ar] 3d84s2;Fe;
(2)同周期从左到右,第一电离能呈现增大的趋势,由于氮原子的2p能级为半充满,较稳定,故C、N、O的第一电离能大小顺序为C<O<N,第一电离能较大的元素为N,
故答案为:N;
(3)①金属元素产生焰色反应的微观原因为:电子从较高能级的激发态跃迁到较低能级的激发态乃至基态 时,会以光的形式释放能量,产生焰色反应,
故答案为:电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,会以光的形式释放能量;
②AsO33中As原子孤电子对数=![]() =1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型为三角锥形;根据价电子总数和原子总数(氢等轻原子不计在内)相同的分子、离子或基团互为等电子体可知,用Cl原子替代O原子、1个单位负电荷可得与AsO33互 为等电子体的分子有PCl3等,进一步替换可得PBr3、NF3、NCl3等,
=1,价层电子对数=1+3=4,在VSEPR模型基础上忽略孤对电子可得微粒空间构型为三角锥形;根据价电子总数和原子总数(氢等轻原子不计在内)相同的分子、离子或基团互为等电子体可知,用Cl原子替代O原子、1个单位负电荷可得与AsO33互 为等电子体的分子有PCl3等,进一步替换可得PBr3、NF3、NCl3等,
故答案为:三角锥形;PCl3、PBr3、NF3、NCl3等;
(4)Ca、Ni都属于金属晶体,Ni的原子半径较小,价层电子数目较多,金属键较强,故金属Ni的熔点和沸点均比金属Ca的高,
故答案为:Ni的原子半径较小,价层电子数目较多,金属键较强;
(5) ①镍的原子堆积方式为面心立方最密堆积,故金属镍晶胞俯视图为C,
答案为C;
②由晶胞结构可知,每个晶胞中含有Ni原子数目=8×![]() +4×
+4×![]() =2,含有2个As原子,晶胞的质量=2×
=2,含有2个As原子,晶胞的质量=2×![]() g,晶胞的体积V=a×10-10cm×a×10-10cm×
g,晶胞的体积V=a×10-10cm×a×10-10cm×![]() ×c×10-10cm=
×c×10-10cm=![]() ×10-30cm3,故晶胞的密度ρ=
×10-30cm3,故晶胞的密度ρ=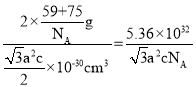 g·cm-3,
g·cm-3,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】氰化钠![]() 是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
![]() 装氰化钠
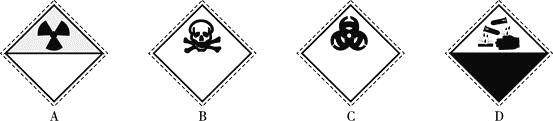
装氰化钠![]() 试剂瓶的标签上应印有下列警示标记中的________
试剂瓶的标签上应印有下列警示标记中的________![]() 填序号
填序号![]() 。
。
![]() 实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
![]() 泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
![]() 化学兴趣小组利用:2NH
化学兴趣小组利用:2NH![]() 反应原理制备NaCN并检测其纯度。
反应原理制备NaCN并检测其纯度。
实验一:制备NaCN装置如图所示
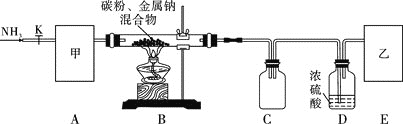
![]() 装置C的作用是____________。甲可选取下列装置中的________
装置C的作用是____________。甲可选取下列装置中的________![]() 填序号
填序号![]() 。
。

![]() 安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________
安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________![]() 填序号
填序号![]() 。
。
A.先打开活塞K,缓缓通入一段时间氨气后再加热硬质玻璃管
B.先加热硬质玻璃管,再打开活塞K,缓缓通入氨气
C.打开活塞K,一边缓缓通入氨气,同时加热硬质玻璃管
![]() 上述装置中乙处还需补充的实验仪器或装置有__________________。
上述装置中乙处还需补充的实验仪器或装置有__________________。
实验二:测定产品中氰化钠的含量
![]() 已知: Ag
已知: Ag![]() ,Ag
,Ag![]() ,AgI呈黄色,且CN
,AgI呈黄色,且CN![]() 优先与Ag
优先与Ag![]() 反应。取制备好的产品
反应。取制备好的产品![]() ,配成
,配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,并滴加
于锥形瓶中,并滴加![]() 滴KI溶液作指示剂,用
滴KI溶液作指示剂,用![]() 的标准AgNO
的标准AgNO![]() 溶液滴定3次,平均消耗AgNO
溶液滴定3次,平均消耗AgNO![]() 溶液的体积为
溶液的体积为![]() 。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________
。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.在一定条件下,氢气与碘蒸汽反应达平衡后,加压,混合气体颜色变深
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于可逆反应的一组是( )
A. 2H2O![]() 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2![]() 2H2O
2H2O
B. NH3+CO2+H2O=NH4HCO3,NH4HCO3![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
C. H2+I2![]() 2HI,2HI
2HI,2HI![]() H2↑+I2↑
H2↑+I2↑
D. 2Ag+Br2![]() 2AgBr,2AgBr
2AgBr,2AgBr![]() 2Ag+Br2
2Ag+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度一定的条件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为
2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
A.新的平衡体系中,N2的浓度小于2c mol·L1大于c mol·L1
B.新的平衡体系中,NH3的浓度小于2c mol·L1大于c mol·L1
C.新的平衡体系中,混合体的平均摩尔质量大于![]()
D.新的平衡体系中,气体密度是原平衡体系的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:
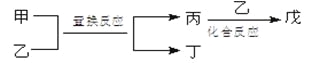
其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | HCOOH |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯过氧化氢(H2O2)是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)过氧化氢中氧元素的化合价是__。
(2)实验室中用过氧化氢制取氧气的化学方程式为__。
(3)同学们用0.1000mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO![]() +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被__(填“氧化”或“还原”);酸性高锰酸钾溶液应装在__(填“酸式”或“碱式”)滴定管中。
②当滴入最后一滴酸性高锰酸钾标准溶液,__即滴定到达终点。
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
则试样中过氧化氢的浓度为___mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果__(填“偏低”、“偏高”或“不变”)。
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲乙两位同学的说法是否正确:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足下列相互转化关系:甲![]() 乙
乙![]() 甲.下列说法正确的是
甲.下列说法正确的是
A.甲有可能是![]() 也有可能是
也有可能是![]()
B.若乙为无色无味气体,则甲一定是![]()
C.若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数
D.若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com