
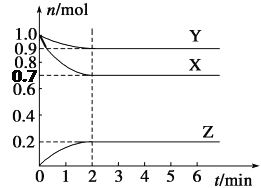
����Ŀ��ij�¶��£���2 L���ܱ������У�X��Y��Z����������ʱ��仯��������ͼ��ʾ��
��ش��������⣺
(1)��ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
(2)��Ӧ��ʼ��2 min��Z��ƽ����Ӧ����Ϊ________��
(3)5 minʱZ������������6 minʱZ������������Ƚϣ�ǰ��________����(����ڡ�����С�ڡ����ڡ�)��
(4)������Ӧ�����У���������¶ȣ����䷴Ӧ����________(���������С������)��
���ʹ�ú��ʵĴ��������䷴Ӧ����________ (���������С������)��
(5)���и�����������˵��������Ӧ�ﵽƽ�����________(����ĸ)��
a�����������ܶȲ���
b����������ѹǿ����
c��ͬһ���ʵ�����Ӧ���ʵ����淴Ӧ����
d��X��Ũ�ȱ��ֲ���
e������1 mol Z��ͬʱ����1.5 mol X
f��X��Y��Z�ķ�Ӧ����֮��Ϊ3��1��2
(6)�����ֲ�ͬ�������²ⶨ�õ����·�Ӧ���ʣ����б�ʾ�ķ�Ӧ����������______��
��v(X)=0.6 mol��L-1��min-1 ��v(Y)=0.2 mol��L-1��min-1
��v(Z)=0.1 mol��L-1��s-1 ��v(Z)=0.1 mol��L-1��min-1
���𰸡� 3X+Y ![]() 2Z 0.05 mol.L-1.min-1 ���� ��С ���� a��f ��
2Z 0.05 mol.L-1.min-1 ���� ��С ���� a��f ��
�����������������
(1)X��Y���ʵ���������X��Y�Ƿ�Ӧ�Z�����ʵ�������Z�������2min�����ʵ������ٸı�����ӦΪ���淴Ӧ���ɸ�����ת��������֪��ѧ����ʽ�и����ʵļ�����֮����
(2)����![]() ���㷴Ӧ������
���㷴Ӧ������
(3)��Ӧ�ﵽƽ���Ӧ���ʲ��ٸı���
(4)�����¶ȷ�Ӧ���ʼ�С��
�����ܼӿ췴Ӧ���ʡ�
(5)����ƽ�ⶨ�����ƽ���־��
��6���ȽϷ�Ӧ������Ҫͳһ���ʵ�λ��ͳһ������
������(1)X��Y���ʵ���������X��Y�Ƿ�Ӧ�Z�����ʵ�������Z�������2min�����ʵ������ٸı�����ӦΪ���淴Ӧ��XΪ0.3 mol��YΪ0.1 mol��ZΪ0.2 mol����֪��ѧ����ʽ�и����ʵĻ�ѧ������֮��Ϊ,3��1��2������ʽΪ3X+Y ![]() 2Z
2Z
(2)����![]() ��
�� ![]() 0.05 mol.L-1.min-1��
0.05 mol.L-1.min-1��
(3)��Ӧ�ﵽƽ���Ӧ���ʲ��ٸı䣬����5 minʱZ���������ʵ���6 minʱZ�����������ࡣ
(4)�����¶ȷ�Ӧ���ʼ�С�������ܼӿ췴Ӧ���ʡ�
(5) a������![]() ,�ܶ��Ǻ���,���������ܶȲ���,��һ��ƽ�⣻
,�ܶ��Ǻ���,���������ܶȲ���,��һ��ƽ�⣻
b����Ӧǰ����������ʵ����ı䣬����ѹǿ�DZ�������������ѹǿ������һ���ﵽƽ��״̬��
c������ƽ�ⶨ�壬ͬһ���ʵ�����Ӧ���ʵ����淴Ӧ������һ���ﵽƽ��״̬��
d������ƽ�ⶨ����X��Ũ�ȱ��ֲ�����һ���ﵽƽ��״̬��
e������1 mol Z��ͬʱ����1.5 mol X�����淴Ӧ������ȣ�һ���ﵽƽ��״̬��
f������ʱ��X��Y��Z�ķ�Ӧ����֮�ȶ���3��1��2����һ��ƽ�⣻��ѡa��f��
��6������![]() ����v(X)��3=0.2 mol��L-1��min-1 �� v(Y) ��1=0.2 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��s-1 =3 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��min-1 ����Ӧ��������������
����v(X)��3=0.2 mol��L-1��min-1 �� v(Y) ��1=0.2 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��s-1 =3 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��min-1 ����Ӧ��������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������Һ��ɷ��������������ӷ�Ӧ��
Ce4����Fe2��===Fe3����Ce3����Sn2����2Fe3��===2Fe2����Sn4��
�ɴ˿���ȷ��Fe3����Ce4����Sn4���������ӵ���������ǿ������˳��( )
A. Sn4����Fe3����Ce4�� B. Sn4����Ce4����Fe3��
C. Ce4����Fe3����Sn4�� D. Fe3����Sn4����Ce4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ�����ɫ��Һ�У����и��������ܴ����������( )
A. K+��Na+��NO3-��Br- B. Na+��NH4+��NO3-��Cl-
C. K+��Na+��HCO3- ��NO3- D. K+��Cu2+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӿ�������Ҫ�������͡����й������ǵ�˵������ȷ����
A. ������������Ӿ��嶼�ܵ���
B. ��þ��������1��Mg2+ֻ��2���۵��Ӵ���ǿ�ҵ������
C. ������������Ӿ��嶼�ɲ�ȡ���ܶѻ���ʽ
D. ������������Ӿ����зֱ���ڽ����������Ӽ���ǿ�ҵ�����ã����Ѷ��ѣ������������չ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������[(NH4)2Fe(SO4)2]�Ƿ�����ѧ�е���Ҫ�Լ���
[��������]��������������500��ʱ�������������ȫ�ֽ⣬�ֽ�����к�����������������������ˮ�����ȡ�
[ʵ��̽��]ij��ѧС��ѡ����ͼ��ʾ����װ�ý���ʵ��(�г�װ����)
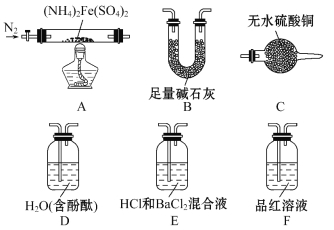
ʵ��� ��֤�ֽ�����к��а�����ˮ��������̽����������ɷ֡�
(1)��ѡ��װ�õ���ȷ����˳��Ϊ_______(��װ�õ���ĸ���)��
(2)֤����ˮ�������ɵ�ʵ������Ϊ___________________________________��
(3)֤���а������ɵ�ʵ������Ϊ_____________________________________��
(4)A�й�����ȫ�ֽ���Ϊ����ɫ��ĩ�����ʵ��֤��A�в��������ΪFe2O3��������FeO��Fe3O4��_______________________��
ʵ��� ��ͬѧΪ̽���ֽ�����е������������װ��A-E-F-B����ʵ�顣
(5)ʵ������й۲쵽��E��û����������F����Һ��ɫ���ݴ˵ó��Ľ�����_________________________________��
(6)B��������_____________________________________��
(7)ʵ��֤��(NH4)2Fe(SO4)2���ȷֽ�����������⣬����N2���ɣ�д��A�з�Ӧ�Ļ�ѧ����ʽ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����۵�Ϊ-107�棬�е�Ϊ12.5�棬��������м����֮��ļн�Ϊ120��������ˮ�⣬�й�������ȷ����
A. ������Һ̬ʱ�ܵ������̬ʱ������ B. �Ȼ�������ԭ�Ӳ���sp�ӻ�
C. �Ȼ������ӳ�ƽ�������Σ����Ǽ��Է��� D. ��������幹������NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�ؿ���ʹ���ں���ɻ��ϣ��䷴Ӧԭ��ʾ��ͼ����ͼ�������й�����ȼ�ϵ�ص�˵������ȷ����
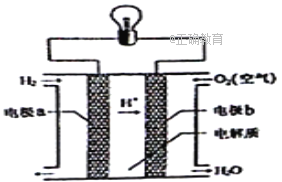
A. ��װ�ý���ѧ��ת��Ϊ����
B. Ϊ�����ӵ������ȣ����Խ��缫̼����ôֲڶ��
C. ����Ǩ�Ʒ��缫a���������缫b���������Һ���缫a
D. �õ�ص��ܷ�Ӧ��2H2+O2=2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�����ǿ����ʵı�����Һ�д����ų����ܽ�ƽ�⣬��ƽ�ⳣ��Ϊ
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp��25���� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
���ں�Fe2(SO4)3��FeSO4��CuSO4��0.5mol�Ļ����Һ1L�������ϱ������жϣ�˵���������
A. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
B. ����Һ�м���˫��ˮ������CuO��ĩ��pH�����˺�ɻ�ϴ�����CuSO4��Һ
C. ����Һ��һ����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]=5��4
D. ������FeCl3��ĩ���뺬Cu��OH��2������Һ�У�����c��Cu2+������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������۷����Ȼ�����Һ�У���ȫ��Ӧ��������Һ��Fe2+��Fe3+�����ʵ���Ũ��֮��Ϊ1��2�����ѷ�Ӧ��Fe3+��δ��Ӧ��Fe3+�����ʵ���֮��Ϊ��������
A.1��1
B.1��2
C.1��3
D.2��3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com