
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行实验(夹持装置略)
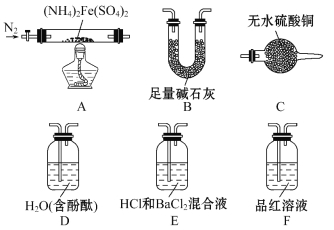
实验Ⅰ 验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
(1)所选用装置的正确连接顺序为_______(填装置的字母序号)。
(2)证明有水蒸气生成的实验现象为___________________________________。
(3)证明有氨气生成的实验现象为_____________________________________。
(4)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4:_______________________。
实验Ⅱ 乙同学为探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验。
(5)实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是_________________________________。
(6)B的作用是_____________________________________。
(7)实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式___________________________________。
【答案】(1)ACBD
(2)C中无水硫酸铜变蓝
(3)D中溶液变为红色
(4)取少量A中残留固体,加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3,而不含FeO或Fe3O4
(5)分解产物中有SO2,没有SO3
(6)吸收SO2,防止污染
(7)2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O
【解析】(1)验证分解产物中含有氨气和水蒸气,为防止后面溶液干扰必须先检验水蒸气,用C中无水硫酸铜检验,再用碱石灰除去水,用含酚酞的水检验氨气,故顺序是ACBD。
(2)无水硫酸铜遇水会变蓝。
(3)氨气溶于水显碱性,故遇酚酞变红。
(4)氧化铁中没有二价铁,氧化亚铁和四氧化三铁中都含有亚铁离子,可使高锰酸钾褪色,故可加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3,而不含FeO或Fe3O4。
(5)SO3遇盐酸酸化的氯化钡会产生白色沉淀,而E中没有明显现象,说明产物中没有SO3,二氧化硫能使品红褪色,F中溶液褪色,故含有二氧化硫。
(6)产物中有二氧化硫会污染空气,故要用碱石灰吸收二氧化硫。
(7)据以上分析产物中含有Fe2O3、SO2、NH3、N2和H2O,故方程式为2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O。
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】每到冬天就会出现大雾天气,能见度不到10米,致使汽车行驶受阻,下列关于雾的说法正确的是( )
A.无法确定雾中水滴的直径大小 B.不会产生丁达尔现象
C.雾中水滴的直径在1nm~100nm间 D.雾中水滴的直径小于1nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷(As),西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是( )
A. 因为河虾中含有砷元素,所以不能食用
B. “两者同食”发生的反应中维生素C作氧化剂
C. 五价砷在维生素C作用下发生了还原反应
D. 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为__________________________________。
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下实验方案。
(1)实验原理。
AlN溶于浓的强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程_________。
(2)实验装置。

如图C装置中球形干燥管的作用是_________________________。
(3)实验过程。
①连接好实验装置________,然后称得C装置的质量为yg。
②称取xg AlN样品置于A装置中;塞好胶塞,关闭________打开________(填“K1”或“K2”);通过分液漏斗加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,称得C装置的质量变为zg,通入氮气的目的是__________________,装置B的作用是__________________________。
(4)数据分析。
①AlN的质量分数为________。(相对原子质量Al:27,N:14)
②由于装置存在缺陷,导致测定结果偏高,请提出改进意见________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
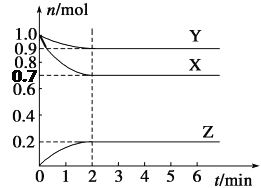
请回答下列问题:
(1)由图中数据分析:该反应的化学方程式为__________________________。
(2)反应开始至2 min,Z的平均反应速率为________。
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者________后者(填“大于”、“小于”或“等于”)。
(4)上述反应过程中,如果降低温度,则其反应速率________(填“增大”、“减小”或“不变)。
如果使用合适的催化剂,则其反应速率________ (填“增大”、“减小”或“不变)。
(5)下列各项中不可以说明上述反应达到平衡的是________(填字母)。
a.混合气体的密度不变
b.混合气体的压强不变
c.同一物质的正反应速率等于逆反应速率
d.X的浓度保持不变
e.生成1 mol Z和同时生成1.5 mol X
f.X、Y、Z的反应速率之比为3∶1∶2
(6)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是______。
①v(X)=0.6 mol·L-1·min-1 ②v(Y)=0.2 mol·L-1·min-1
③v(Z)=0.1 mol·L-1·s-1 ④v(Z)=0.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示.
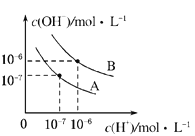
(1)95℃时水的电离平衡曲线应为______(填“A”或“B”),理由是______.
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH______7.
(3)在曲线B所对应的温度下,将0.02molL﹣1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
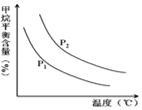
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com