

分析 (1)硫酸的化合价从+5变为+4,化合价降低被还原,表现了氧化性,作氧化剂;根据反应计算出消耗碳的物质的量,再根据m=nM计算出消耗C的质量,根据V=nVm计算出生成的标况下二氧化碳的体积;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,据此可以检验二氧化硫;
(4)二氧化碳与氢氧化钙反应生成白色的碳酸钙沉淀;
(5)用品红溶液具有是否存在二氧化硫气体;
(6)空气中含有大量二氧化硫气体,会组成酸雨现象;温室效应的罪魁祸首为二氧化碳;
(7)从减少化石燃料、节约能源等方面考虑可以采取的切实可行的措施.
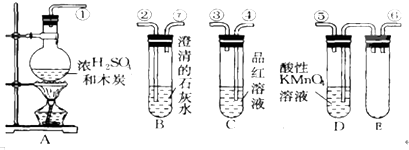
解答 解:(1)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)═CO2↑+2SO2↑+2H2O,反应中硫酸分子中S元素的化合价降低,被含有,所以浓H2S04所起的作用为氧化剂;若有0.2mol的H2S04完全参加反应,则消耗碳的物质的量为0.1mol,质量为:12g/mol×0.1mol=1.2g,同时产生的CO2的物质的量为0.11mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L,
故答案为:氧化剂; 1.2;2.24L;
(2)反应中有二氧化硫生成,则图一的A装置中品红溶液颜色褪色,证明了混合气体中含有SO2,
故答案为:褪色; SO2(或二氧化硫);
(4)澄清石灰水中通入二氧化碳,二者反应生成白色的碳酸钙沉淀,
故答案为:白色;
(5)二氧化硫能够使品红溶液褪色,应该在B、C装置之间连接图2中的a-品红溶液,用于检验二氧化硫气体是否除尽,
故答案为:a;
(6)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是酸雨,所以A正确;
二氧化碳造成的环境影响主要是温室效应,所以C正确,
故答案为:A;C;
(7)体现低碳理念的事例有:①采周乘坐公共交通工具、骑自行车或步行等方式出行,②少用私家车或节约用水、用电,③改善能源结构,开发新能源(开发无污染的太阳能、风能、地热能),
故答案为:采周乘坐公共交通工具、骑自行车或步行等方式出行,少用私家车(或节约用水、用电;改善能源结构,开发新能源,如:开发无污染的太阳能、风能、地热能).
点评 本题考查了浓硫酸的性质,题目难度中等,明确浓硫酸与碳的反应原理及二氧化硫、二氧化碳的检验方法为解答关键,注意检验二氧化碳时,必须排除二氧化硫的干扰,为易错点,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与浓度相等的稀盐酸反应的速率为Q>L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
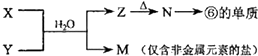 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| W | |||||||
| X | Y | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:
我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ•mol-1 | |||||||||||
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol
| |||||||||||
| C. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6 kJ/mol | |||||||||||
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com