
 我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:
我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:分析 (1)根据原子守恒法书写反应的化学方程式;
(2)根据盖斯定律进行计算,书写热化学方程式;
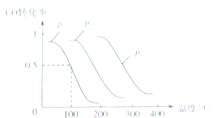
(3)①从图中可以分析得到温度越高,CO的转化率降低;
在相同的温度时,压强越大,CO转化率越大;
②根据平衡三段式计算出平衡时各物质的浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
在温度不变的条件下,向该容器中再加人nmolCO与2n mo1H2,相当增大压强,平衡向气体分子数减小的方向移动;
③提高CO的转化率,即平衡正向移动,可采取的措施有:增大另一只反应物的浓度、减小生成物浓度等.
解答 解:(1)煤与水蒸气生成水煤气的化学方程式为:2CH+2H2O(g)$\stackrel{高温}{→}$ 2CO+3H2,
故答案为:2CH+2H2O(g)$\stackrel{高温}{→}$ 2CO+3H2;
(2)①2CH(s)+O2(g)=2CO(g)+H2(g)△H1
②CO(g)+2H2(g)=CH3OH(g)△H2
③3CH3OH(g)=C3H6(g)+3H2O(g)△H3
①×6+②×3+③得,12CH(s)+6O2(g)═C3H6(g)+3H2O(g)+9CO(g)△H=6△H1+3△H2+△H3,
故答案为:12CH(s)+6O2(g)═C3H6(g)+3H2O(g)+9CO(g)△H=6△H1+3△H2+△H3;
(3)①从图中可以分析得到温度越高,CO的转化率降低,平衡逆向移动,故正反应方向是放热的;
在相同的温度时,CO的转化率不同,压强越大转化率越大,故P1<P2<P3;
故答案为:放热,P1<P2<P3;
②容器容积为VL,反应压强为pl时CO的转化率为0.5,
CO(g)+2H2(g)?CH3OH(g)
起始时 n mol 2n mo1
转化 0.5n mol n mo1 0.5n mol
平衡时 0.5n mol n mo1 0.5n mol
c(CH3OH)=$\frac{0.5n}{V}$mol/L,c(H2)=$\frac{n}{V}$mol/L,c(CO)=$\frac{0.5n}{V}$mol/L,
故平衡常数K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})c(CO)}$=$\frac{\frac{0.5n}{V}}{\frac{n}{V}×\frac{n}{V}×\frac{0.5n}{V}}$=$\frac{{V}^{2}}{{n}^{2}}$,
在温度不变的条件下,向该容器中再加人nmolCO与2nmo1H2,相当于在原有的基础上把容器的体积缩小为原来的一半,压强增大,平衡正向移动,反应物CO的转化率增大,
故答案为:$\frac{{V}^{2}}{{n}^{2}}$,增大;
③提高CO的转化率,即平衡正向移动,可采取的措施有:加入氢气、分离出产物甲醇等,
故答案为:加入氢气、分离出产物甲醇.
点评 本题考查化学方程式的书写、盖斯定律的应用、化学平衡移动原理及平衡常数的计算等,浓度中等.要注意平衡三段式的运用是解题的关键.


科目:高中化学 来源: 题型:解答题

 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.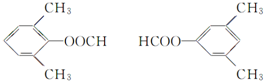 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
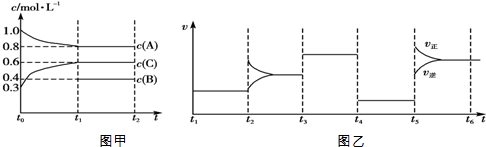
| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响 | |
| B. | 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高 | |
| C. | 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响 | |
| D. | 现需90mL 1.0mol•L-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 食醋的体积/mL | 所用氢氧化钠溶液的体积/mL | |
| 第一次 | 20.00 | 19.8 |
| 第二次 | 20.00 | 21.2 |
| 第三次 | 20.00 | 19.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com