

 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.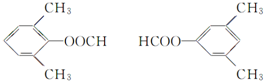 .
. 分析 C的产量可用来衡量一个国家的石油化工发展水平,则C为CH2=CH2,乙烯与水发生加成反应生成D为CH3CH2OH,D发生催化氧化生成E为CH3CHO,E与银氨溶液发生氧化反应、酸化生成F为CH3COOH,甲苯与氯气在光照条件发生甲基上的取代反应生成A,A发生水解反应生成B,B与F反应生成G(C9H10O2),由G的分子式可知,B为一元醇,故A为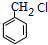 ,B为
,B为 ,G为
,G为 ,据此解答.
,据此解答.
解答 解:C的产量可用来衡量一个国家的石油化工发展水平,则C为CH2=CH2,乙烯与水发生加成反应生成D为CH3CH2OH,D发生催化氧化生成E为CH3CHO,E与银氨溶液发生氧化反应、酸化生成F为CH3COOH,甲苯与氯气在光照条件发生甲基上的取代反应生成A,A发生水解反应生成B,B与F反应生成G(C9H10O2),由G的分子式可知,B为一元醇,故A为 ,B为
,B为 ,G为
,G为 ,
,
(1)G为 ,
,
故答案为: ;
;
(2)A转化为B是卤代烃的水解反应,也属于取代反应,C转化为D是乙烯与是发生加成反应生成乙醇,
故答案为:水解反应或取代反应;加成反应;
(3)D生成E的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,B和F生成G的化学方程式为 +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O,
+H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O; +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O;
故答案为: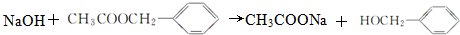 ;
;
(4)符合下列条件的 的同分异构体:能够与新制的银氨溶液反应产生光亮的银镜,含有-CHO,苯环上有3个取代基,且有两个取代基相同,还含有2个-CH3,另外取代基为-OOCH,2个-CH3相邻,-OOCH有2种位置,2个-CH3处于间位,-OOCH有3种位置,2个-CH3处于对位,-OOCH有1种位置,故符合条件的同分异构体有2+3+1=6种,其中氢原子共有四种不同环境的所有物质的结构简式为:
的同分异构体:能够与新制的银氨溶液反应产生光亮的银镜,含有-CHO,苯环上有3个取代基,且有两个取代基相同,还含有2个-CH3,另外取代基为-OOCH,2个-CH3相邻,-OOCH有2种位置,2个-CH3处于间位,-OOCH有3种位置,2个-CH3处于对位,-OOCH有1种位置,故符合条件的同分异构体有2+3+1=6种,其中氢原子共有四种不同环境的所有物质的结构简式为: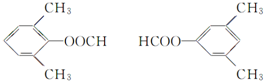 ,
,
故答案为:6;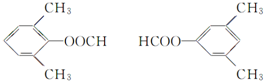 .
.
点评 本题考查有机物推断,涉及烃、醇、醛、羧酸的性质与转化等,难度不大,是对常见有机物知识的简单运用,(4)中注意运用“定二移一法”书写同分异构体.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| D. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 | |
| D. | 中子数为39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与浓度相等的稀盐酸反应的速率为Q>L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 | |
| B. | 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 | |
| C. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| D. | 对于同一元素而言,原子的逐级电离能越来越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同的原子之间只能构成共价化合物 | |
| B. | 单质中不一定存在非极性键 | |
| C. | 非金属原子之间只能构成共价化合物 | |
| D. | Cl2的沸点比F2高,这与化学建的大小有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12 mol | B. | 0.11 mol | C. | 0.09 mol | D. | 0.08 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:
我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com